Химия
Молярные концентрации ионов H+ и OH− в водных растворах взаимосвязаны: при увеличении концентрации ионов водорода (добавление кислоты) концентрация гидроксид-ионов уменьшается, а при увеличении концентрации гидроксид-ионов (добавление щелочи) уменьшается концентрация ионов водорода. При этом произведение равновесных молярных концентраций ионов H+ и OH− остается постоянным:
c(H+) ⋅ c(OH−) = 10−14,
поэтому, зная концентрацию одного из ионов (Н+ или ОН−), можно найти концентрацию другого, например:
с(ОН−) = 10−14/с(Н+).
Растворы, в которых c(H+) = c(OH−), называются нейтральными, а растворы, в которых c(H+) > c(OH−) и c(H+) < c(OH−) — соответственно кислыми и щелочными.
Для характеристики кислотно-основных свойств среды на практике удобно использовать так называемый водородный показатель pH, который равен показателю степени молярной концентрации ионов водорода, взятому с противоположным знаком, например: c(H+) = 10−2, pH = −(−2) = 2, а точнее: pH = −lg c(H+).
Шкала изменения рН водных растворов электролитов:
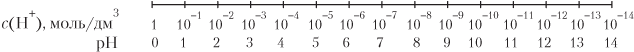
В табл. 11.4 приведены характеристики сред различного типа с указанием окраски в них некоторых индикаторов.
| Тип среды | Значение pH | Соотношение концентраций ионов H+ и OH− | Цвет индикатора | ||
|---|---|---|---|---|---|
| Лакмус фиолетовый | Фенолфталеин | Метилоранж | |||
| Нейтральная | pH = 7 | c(H+) = c(OH−) | Фиолетовый | Бесцветный | Оранжевый |
| Кислая | pH < 7 | c(H+) > c(OH−) | Красный | Бесцветный | Красный |
| Щелочная | pH > 7 | c(H+) < c(OH−) | Синий | Малиновый | Желтый |
1. Чем меньше значение pH, тем больше кислотность раствора и концентрация в нем ионов водорода и меньше концентрация гидроксид-ионов.
2. Чем больше значение pH, тем больше щелочность раствора и концентрация в нем гидроксид-ионов и меньше концентрация ионов водорода
В организме человека различные жидкости имеют разное значение pH: 1,7 — желудочный сок; 7,4 — кровь; 6,9 — слюна; 7,0 — слезы (у здорового человека).
Пример 11.7. В растворе объемом 200 см3 находится серная кислота массой 0,098 г. Считая диссоциацию полной по обеим стадиям, определите pH раствора.
Решение.
M(H2SO4) = 98 г/моль; V(р-ра) = 200 см3 = 0,2 дм3.
Записываем уравнение электролитической диссоциации и проводим расчеты:
,
n(H2SO4) = m(H2SO4)/M(H2SO4) = 0,098/98 = 0,001 (моль),
n(H+) = 2n(H2SO4) = 0,002 моль;
с(H+) = n(H+)/V (р-ра) = 0,002/0,2 = 0,01 = 10−2 (моль/дм3),
pH = 2.
Ответ: 2.
Пример 11.8. В растворе одноосновной кислоты HAn число непродиссоциировавших молекул в 10 раз больше суммарного числа ионов H+ и An−. Определите pH раствора, если исходная молярная концентрация кислоты равна 0,021 моль/дм3.
Решение. Записываем схему процесса диссоциации
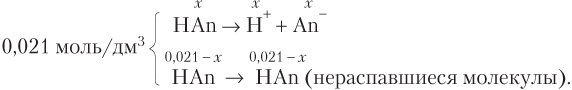
Пусть молярная концентрация продиссоциировавшей кислоты равна x (моль/дм3). Тогда согласно схеме имеем:
.
Откуда
x = 0,001 моль/дм3 = 10−3 моль/дм3.
c(H+) = x = 10−3 моль/дм3, т.е. pH = 3.
Ответ: 3.
Пример 11.9. Укажите, при растворении каких веществ в воде pH образующегося раствора меньше 7: а) NH3; б) SO3; в) CO; г) HCl.
1) а, б;
2) б, г;
3) б, в, г;
4) а, в, г.
Решение. Значение рН раствора уменьшается, если при растворении вещества образуется кислота.
Кислота образуется при растворении в воде SO3 (SO3 + H2O = = H2SO4) и HCl. В этих случаях pH < 7.
При растворении в воде аммиака образуются ионы OH− (pH > 7):
Оксид углерода(II) является несолеобразующим оксидом и с водой при обычных условиях не реагирует (pH = 7).
Ответ: 2).










