Химия
Растворимы в дистиллированной воде хлорид натрия NaCl, карбонат натрия Na2CO3, хлорид алюминия AlCl3. Затем с помощью кислотно-основных индикаторов проверим характер среды полученных растворов. Оказалось, что реакция среды раствора NaCl нейтральная, раствора Na2CO3 щелочная, раствора AlCl3 кислая. Это означает, что в растворе NaCl концентрация ионов Н+ и ОН− одинаковая, в растворе Na2CO3 имеется избыток ионов ОН−, а в растворе AlCl3 — ионов Н+. Как объяснить, что в растворе соли появляется избыток ионов Н+ или ОН−?
Поскольку соли в растворе находятся в виде ионов, то, очевидно, появление в их растворах избытка ионов Н+ или ОН− — это результат взаимодействия ионов соли с водой.
Гидролиз соли — это обменное взаимодействие соли с водой, приводящее к образованию слабых электролитов.
Для большинства солей гидролиз — процесс обратимый, поэтому в уравнениях реакций гидролиза ставится знак обратимости «⇄».
Однако не все соли взаимодействуют с водой. Если рассматривать соль как продукт реакции нейтрализации основания KtOH кислотой HAn (Kt — катион, An — анион)
KtOH + HAn = KtAn + H2O,
то можно понять, чем NaCl отличается от AlCl3 и Na2CO3: хлорид натрия образуется при взаимодействии сильного основания NaOН и сильной кислоты НCl, хлорид алюминия — слабого основания Al(ОН)3 и сильной кислоты НCl, Na2CO3 — сильного основания NaOН и слабой кислоты Н2CO3.
Таким образом, гидролизу подвергаются соли сильного основания и слабой кислоты, слабого основания и сильной кислоты, а также слабого основания и слабой кислоты. Только в этих случаях обменное взаимодействие соли с водой приводит к образованию слабого электролита, что является одним из обязательных условий протекания обменных реакций.
Соли сильного основания и сильной кислоты (NaCl, KNO3, Na2SO4, BaI2 и др.) гидролизу не подвергаются, так как их ионы с водой не образуют слабого электролита. В растворах этих солей среда нейтральная (pH = 7)
Например:
NaCl → Na+ + Cl−
Na+ + H+OH− (NaОН — сильное основание),
Cl− + H+OH− (НCl — сильная кислота).
Таким образом, среда раствора в солях сильного основания и кислоты нейтральная (pH = 7).
Гидролизу по аниону подвергаются соли сильного основания и слабой кислоты (KCN, Na2CO3, Na2S, CH3COONa и др.). Среда их водных растворов щелочная (pH > 7).
При растворении в воде соль, например фторид калия KF, диссоциирует на ионы:
KF → K+ + F−
Ионы калия взаимодействовать с водой не будут, так как продукт такого взаимодействия — гидроксид калия KОН — является сильным электролитом:
K+ + НОН (реакция не идет).
Фторид-ионы при взаимодействии с водой образуют слабый электролит — фтороводородную кислоту:
F− + НОН ⇄ НF + ОН−
Следовательно, можно записать
KF + НОН ⇄ НF + KОН
В результате в растворе накапливается избыток гидроксид-ионов, среда становится щелочной.
Гидролиз солей с многозарядным анионом протекает ступенчато, причем в основном по первой ступени. Например:
K2S → K+ + S2−
1) S2− + HOH ⇄ HS− + ОН− или K2S + HOH ⇄ KHS + KОН;
2) HS− + HOH ⇄ H2S + ОН− или KHS + HOH ⇄ H2S + KОН.
Гидролизу по катиону подвергаются соли слабого основания и сильной кислоты (NH4, AlCl3, Cu(NO3)2 и др.). Среда их водных растворов кислая (pH < 7).
При растворении в воде соль, например бромид аммония NH4Br, диссоциирует на ионы:
NH4Br → + Br−
Ионы брома взаимодействовать с водой не будут, так как продукт такого взаимодействия — бромоводородная кислота — сильный электролит:
Br− + НОН (реакция не идет).
Ионы аммония при взаимодействии с водой образуют слабый электролит NH3 · Н2О:
+ НОН ⇄ NH3 · Н2О + Н+
При этом высвобождаются ионы водорода Н+, которые и обусловливают кислую среду раствора (pH < 7). Уравнение реакции гидролиза этой соли в молекулярной форме:
NH4Br + НОН ⇄ NH3 · Н2О + HBr
Гидролиз солей с многозарядным катионом протекает ступенчато и в основном по первой стадии. Например:
Al(NO3)3 → Al3+ +
1) Al3+ + HOH ⇄ AlOH2+ + H+
Al(NO3)3 + HOH ⇄ AlOH(NO3)2 + HNO3;
2) AlOH2+ + HOH ⇄ + H+
AlOH(NO3)2 + HOH ⇄ Al(OH)2NO3 + HNO3.
Рассмотрим, как протекает гидролиз солей слабого основания и слабой кислоты, т.е. солей типа NH4CN, Al2S3, AgF и др., на примере ацетата аммония. Уравнение диссоциации соли:
CH3COONH4 → + CH3COO−
С водой взаимодействуют и катионы, и анионы:
+ HOH ⇄ NH3 · H2O + H+
CH3COO− + HOH ⇄ CH3COOH + OH−
Суммируя эти два процесса и учитывая, что образующиеся ионы H+ и OH− взаимодействуют с образованием молекулы воды, можно записать уравнение гидролиза соли в молекулярной форме:
CH3COONH4 + HOH ⇄ CH3COOH + NH3 · H2O
Характер среды растворов таких солей определяется не образующимися ионами H+ или OH−, а тем, какой из двух слабых электролитов является более сильным. Гидрат аммиака и уксусная кислота — слабые электролиты, однако уксусная кислота несколько более сильный электролит, чем NH3 · H2O, поэтому в растворе больше концентрация ионов водорода, которые и обусловливают кислую среду (pH < 7).
Соли данного типа с многозарядными катионами и анионами (Al2(CO3)3, Fe2S3, Cr2(SO3)3, Al2S3 и др.) подвергаются гидролизу особенно интенсивно, и в ряде случаев — необратимо:
Al2S3 + 6HOH = 2Al(OH)3↓ + 3H2S↑
По этой причине нельзя получить сульфид алюминия обменной реакции между двумя солями в водном растворе:
AlCl3 + K2S Al2S3 + KCl
Сульфид алюминия получают взаимодействием простых веществ в отсутствие влаги:
2Al + 3S 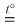
Факторы, влияющие на процесс гидролиза. Поскольку гидролиз — процесс обратимый, то добавление воды будет способствовать смещению равновесия вправо, т.е. при разбавлении раствора гидролиз соли усиливается.
Все реакции нейтрализации идут с выделением теплоты. Гидролиз — процесс, обратный нейтрализации, следовательно, гидролиз — процесс эндотермический:
соль + вода ⇄ продукты гидролиза — Q.
Согласно принципу Ле Шателье, повышение температуры для таких процессов способствует смещению равновесия вправо, т.е. усиливается гидролиз соли.
Процессы гидролиза солей сопровождаются выделением ионов H+ или OH−, поэтому добавление кислоты к раствору соли, гидролиз которой проходит по катиону, т.е. с образованием ионов H+, смещает равновесие влево, в результате процесс гидролиза подавляется. Добавление щелочи к этому же раствору, наоборот, приводит к смещению равновесия вправо, так как ионы OH− будут связывать ионы H+ в молекулы воды, т.е. гидролиз усилится.
Усилить или ослабить гидролиз данной соли можно добавлением другой соли, которая также подвергается гидролизу. Для ослабления гидролиза соли, протекающего по аниону (pH > 7), необходимо добавить в раствор соль, также гидролизирующуюся по аниону (возрастает концентрация гидроксид-ионов); например, в раствор Nа2S добавить K2CO3. Гидролиз сульфида натрия усилится при добавлении в водный раствор соли, которая гидролизируется по катиону (уменьшается концентрация ионов OH−), например NH4Cl. Чтобы ослабить гидролиз соли, протекающий по катиону, в ее водный раствор добавляют соль такого же типа (возрастает концентрация ионов H+); например, к раствору CuCl2 добавляют Al2(SO4)3. Гидролиз таких солей усилится при добавлении к их раствору солей, в водных растворах которых среда щелочная, т.е. гидролизирующихся по аниону; например, к раствору CuCl2 можно добавить CH3COONa.
Степень протекания гидролиза зависит от силы кислоты или основания: чем меньше степень диссоциации электролита, тем эффективнее соль подвергается гидролизу.
Степень гидролиза соли по аниону в ряду:
F−, , CH3COO−, , , , S2−
возрастает слева направо.
Степень гидролиза соли по катиону в ряду:
Mn2+, Zn2+, Cu2+, Fe2+, Pb2+, Al3+, Cr3+, Fe3+
также возрастает слева направо.
Средние соли многоосновных слабых кислот в большей степени подвергаются гидролизу, чем кислые. Например, в водных растворах Na3PO4 и Na2CO3 среда более щелочная, чем в водных растворах соответственно Na2HPO4 и NaHCO3 (молярные концентрации солей одинаковые).
В отдельных случаях процессы гидролиза и электролитической диссоциации конкурируют, что отражается на характере среды. Например, в водных растворах гидрофосфатов среда кислая, так как процесс электролитической диссоциации
⇄ + H+
превалирует над гидролизом
+ HOH ⇄ H3PO4 + OH−
Гидролиз солей — частный случай распространенного в природе явления гидролиза как неорганических, так и органических соединений. Гидролиз белков, жиров и углеводов — одна из важнейших составных частей усвоения продуктов питания организмами. В неживой природе гидролиз — один из процессов, в результате которого происходит разрушение одних горных пород и образование других, в том числе и почвообразующих.










