Химия
Химическая связь — это электростатическое взаимодействие электронов и ядер, которое объединяет отдельные атомы в более сложные системы (молекулы, кристаллы и т.д.).
В системе ядра атомов + электроны действуют электростатические силы отталкивания (↔) и притяжения (→←), например, для двух ядер и двух электронов:
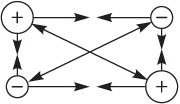
Причина образования химической связи — стремление атомов посредством взаимодействия с другими атомами достичь более устойчивого состояния, т.е. состояния с минимальной энергией.
Таким образом, основное условие образования химической связи — понижение полной энергии E многоатомной системы по сравнению с суммарной энергией изолированных атомов. Например, для образования связи А–Б при взаимодействии атомов А и Б имеем:
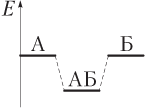
Поскольку E АБ < E А + E Б, то при образовании химической связи энергия всегда выделяется (экзотермический процесс). Напротив, для разрыва химической связи энергию необходимо затратить (эндотермический процесс).
Образование химической связи — процесс самопроизвольный.
Инертность благородных газов, в атомах которых внешний электронный слой завершен, т.е. содержит дублет (атом Не) или октет (атомы Ne, Аr, Хе, Кr) электронов, позволяет предположить, что в процессе образования химической связи атомы других элементов также стремятся завершить свой внешний электронный слой.
Согласно одной из ранних теорий химической связи (Г. Льюис) устойчивый электронный дублет или октет формируется за счет того, что каждый из взаимодействующих атомов дает на образование химической связи один или несколько электронов внешнего электронного слоя. В дальнейшем установили, что взаимодействуют в первую очередь неспаренные электроны.
На рис. 4.1. показано формирование дублета или октета электронов на примере некоторых простейших молекул (электроны разных атомов обозначены точками и звездочками).
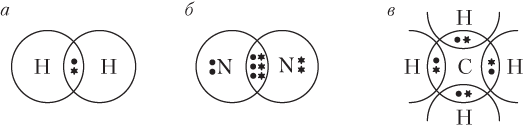
Другая модель образования химической связи (В. Коссель) предполагает, что устойчивые завершенные электронные оболочки формируются за счет полного перехода электрона (электронов) от одного атома к другому, как это происходит при взаимодействии атомов типичных металла и неметалла; например, в случае NaCl имеем:
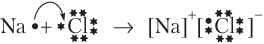
В результате образуются катион Na+ с электронной оболочкой благородного газа неона (1s 22s 22p 6) и анион Cl− с электронной оболочкой благородного газа аргона (1s 22s 22p 63s 23p 6).
Рассмотренные выше модели в дальнейшем легли в основу теории ковалентной связи (Г. Льюис) и ионной связи (В. Коссель).










