Химия
Периодически изменяются следующие свойства простых и сложных веществ:
- строение простых веществ (вначале немолекулярное, например от Li к C, а затем молекулярное: N2 — Ne);
- температуры плавления и кипения простых веществ: при движении слева направо по периоду t пл и t кип вначале, в целом, возрастают (алмаз — самое тугоплавкое вещество), а затем уменьшаются, что связано с изменением строения простых веществ (см. выше);
- металлические и неметаллические свойства простых веществ. По периоду с ростом Z способность атомов отдавать электрон уменьшается (Е и растет), соответственно металлические свойства простых веществ ослабевают (неметаллические — усиливаются, поскольку увеличивается Е ср атомов). Сверху вниз по группам А, напротив, металлические свойства простых веществ усиливаются, а неметаллические — ослабевают;
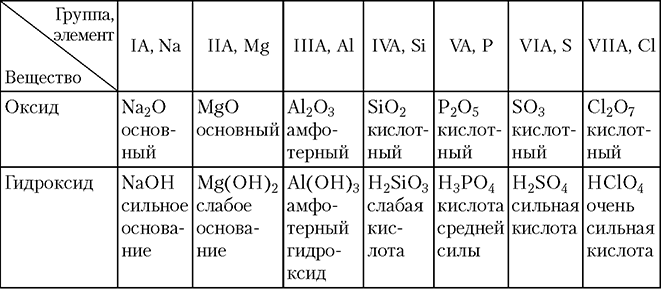
- состав и кислотно-основные свойства оксидов и гидроксидов (табл. 3.1–3.2).
| Группа | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
|---|---|---|---|---|---|---|---|
| Формула высшего оксида | Э2O | ЭO | Э2O3 | ЭO2 | Э2O5 | ЭO3 | Э2O7 |
| Формула простейшего водородного соединения | ЭH | ЭH2 | ЭH3 | ЭH4 | ЭH3 | ЭH2 (Н2Э) | ЭH (НЭ) |
Как видно из табл. 3.1, состав высших оксидов изменяется плавно в соответствии с постепенным возрастанием ковалентности (степени окисления) атома.
С ростом заряда ядра атома в периоде основные свойства оксидов и гидроксидов ослабевают, а кислотные — усиливаются. Переход от основных оксидов и гидроксидов к кислотным в каждом периоде происходит постепенно, через амфотерные оксиды и гидроксиды. В качестве примера в табл. 3.2 показано изменение свойств оксидов и гидроксидов элементов 3-го периода.
В группах А с ростом заряда ядра атома происходит усиление основных свойств оксидов и гидроксидов. Например, для IIA-группы имеем:
1. BeO, Be(OH)2 — амфотерные (слабые основные и кислотные свойства).
2. MgO, Mg(OH)2 — слабые, основные свойства.
3. CaO, Ca(OH)2 — выраженные основные свойства (щелочи).
4. SrO, Sr(OH)2 — выраженные основные свойства (щелочи).
5. BaO, Ba(OH)2 — выраженные основные свойства (щелочи).
6. RaO, Ra(OH)2 — выраженные основные свойства (щелочи).
Такие же тенденции прослеживаются и для элементов других групп (состав и кислотно-основные свойства бинарных водородных соединений см. в табл. 3.1). В целом с ростом атомного номера по периоду основные свойства водородных соединений ослабевают, а кислотные свойства их растворов усиливаются: гидрид натрия растворяется в воде с образованием щелочи:
NaH + H2O = NaOH + H2,
а водные растворы H2S и HCl — кислоты, причем более сильной является хлороводородная кислота.
1. В группах А с ростом заряда ядра атома сила бескислородных кислот также возрастает.
2. В водородных соединениях число атомов водорода в молекуле (или формульной единице) сначала возрастает от 1 до 4 (группы IA–IVA), а затем уменьшается от 4 до 1 (группы IVA–VIIA).
3. Летучими (газообразными) при н.у. являются только водородные соединения элементов IVA–VIIA групп (кроме H2O и HF)
Описанные тенденции в изменении свойств атомов химических элементов и их соединений суммированы в табл. 3.3
| Свойства | Тенденция изменения | |
|---|---|---|
| в периодах | в группах А | |
| Радиус атома | Уменьшается | Растет |
| Энергия ионизации | Возрастает | Уменьшается |
| Сродство к электрону | Возрастает | Уменьшается |
| Восстановительные (металлические) свойства атомов | Ослабевают | Усиливаются |
| Окислительные (неметаллические) свойства атомов | Усиливаются | Ослабевают |
| Электроотрицательность | Возрастает | Уменьшается |
| Максимальная степень окисления | Возрастает | Постоянная |
| Кислотные свойства оксидов | Усиливаются | Ослабевают |
| Кислотные свойства гидроксидов | Усиливаются | Ослабевают |
| Кислотные свойства водородных соединений | Усиливаются | Усиливаются |
| Металлические свойства простых веществ | Ослабевают | Усиливаются |
| Неметаллические свойства простых веществ | Усиливаются | Ослабевают |
Пример 3.3. Укажите формулу оксида с наиболее выраженными кислотными свойствами:
1) Br2O7;
2) SiO2;
3) Al2O3;
4) Cl2O7.
Решение. Кислотные свойства оксидов усиливаются слева направо по периоду, а сверху вниз по группе А ослабевают. С учетом этого приходим к выводу, что кислотные свойства наиболее выражены у оксида Cl2O7.
Ответ: 4).
Пример 3.4. Анион элемента Э2− имеет электронную конфигурацию атома аргона. Укажите формулу высшего оксида атома элемента:
1) ЭО3;
2) Э2О7;
3) Э2О5;
4) ЭО2.
Решение. Электронная конфигурация атома аргона 1s 22s 22p 63s 23p 6, следовательно электронная конфигурация атома Э (атом Э содержит на 2 электрона меньше, чем ион Э2−) – 1s 22s 22p 63s 23p 4, что отвечает атому серы. Элемент сера находится в VIA-группе, формула высшего оксида элементов этой группы ЭО3.
Ответ: 1).
Пример 3.5. Укажите символ элемента, атом которого имеет три электронных слоя и образует летучее (н.у.) соединение состава ЭН2(H2Э):
1) P;
2) Mg;
3) S;
4) Cl.
Решение. Водородные соединения состава ЭН2(H2Э) образуют атомы элементов IIA- и VIA-групп, однако летучими при н.у. являются соединения элементов VIA-группы, к числу которых относится сера.
Ответ: 3).
Охарактеризованные тенденции в изменении кислотно-основных свойств оксидов и гидроксидов можно понять на основании анализа следующих упрощенных схем строения оксидов и гидроксидов (рис. 3.1).
Из упрощенной схемы реакции
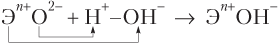
следует, что эффективность взаимодействия оксида с водой с образованием основания возрастает (согласно закону Кулона) с увеличением заряда на ионе Э n +. Величина же этого заряда увеличивается по мере усиления металлических свойств элементов, т.е. справа налево по периоду и сверху вниз по группе. Именно в таком порядке увеличиваются и основные свойства элементов.
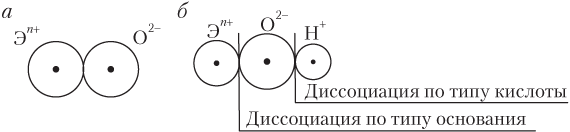
Рассмотрим причины, лежащие в основе описанных изменений кислотно-основных свойств гидроксидов.
При возрастании степени окисления элемента +n и уменьшении радиуса иона Э n + (это как раз и наблюдается с ростом заряда ядра атома элемента слева направо по периоду) связь Э–О упрочняется, а связь О–Н ослабевает; более вероятным становится процесс диссоциации гидроксида по кислотному типу.
Сверху вниз по группе радиус Э n + возрастает, а значение n+ не изменяется, в результате прочность связи Э–О уменьшается, облегчается ее разрыв и более вероятным становится процесс диссоциации гидроксида по основному типу.