Химия
Состояние электрона в атоме полностью описывается набором из четырех параметров, называемых квантовыми числами:
- главное квантовое число n;
- орбитальное или побочное квантовое число l;
- магнитное квантовое число m l ;
- спиновое квантовое число m s .
Квантовые числа n, l, m взаимосвязаны и являются корнями квантово-механического уравнения, описывающего движение электрона в атоме. Спиновое квантовое число с ними никак не связано, оно было введено для описания магнитных свойств электрона.
Главное квантовое число n является важнейшей характеристикой электрона: определяет его энергию, может принимать только целочисленные значения (n = 1, 2, 3, ..., ∞).
Совокупность состояний электрона с одинаковым значением главного квантового числа n называется энергетическим уровнем или электронным слоем, электронной оболочкой.
Энергетические уровни в соответствии со значением n обозначаются цифрами 1, 2, 3, ..., причем для ближайшего к ядру энергетического уровня n = 1. Таким образом, энергия электрона в атоме принимает не любые, а строго определенные значения, поэтому говорят о наборе энергетических уровней. Связь энергии E с главным квантовым числом:
.
Согласно этой формуле допустимые значения энергии электрона обратно пропорциональны n 2, но поскольку они отрицательные, то с увеличением n, т.е. по мере удаления электрона от ядра, его энергия возрастает. При n → ∞ энергия электрона настолько велика, что позволяет ему покинуть атом; атом при этом превращается в положительно заряженный ион. По мере роста n различия в энергии уровней уменьшаются и они сближаются между собой.
Помимо энергии электрона главное квантовое число определяет также:
- размеры атомной орбитали (АО): чем больше значение n, тем больше размеры АО;
- общее число N(AO) в пределах данного энергетического уровня:
N(AO) = n 2.
Например, первые три энергетических уровня (n = 1, 2, 3) имеют соответственно одну, четыре и девять атомных орбиталей.
Важно отметить, что атом каждого химического элемента имеет бесконечное число энергетических уровней, однако в основном состоянии атома (т.е. наименьшем по энергии) электронами заселена только часть из них с наименьшей энергией. Для атома в основном состоянии число энергетических уровней, на которых находятся электроны, равно номеру того периода периодической системы, где он расположен. Если электронам сообщить дополнительную энергию (например, нагреть вещество до высокой температуры), то они с более низкого энергетического уровня перейдут на более высокий, при этом атом переходит в возбужденное состояние. Переход атома из возбужденного в основное состояние сопровождается испусканием фотонов. Атомный спектр испускания состоит из ряда линий, каждая из которых соответствует разности энергий между определенными электронными уровнями энергии и характеризуется значением частоты испускаемого света. В ряде случаев эти линии обладают большой интенсивностью, что служит для аналитического определения атомов. Например, в атомных спектрах испускания атомов натрия и калия выделяются по интенсивности соответственно желтая и фиолетовая линии.
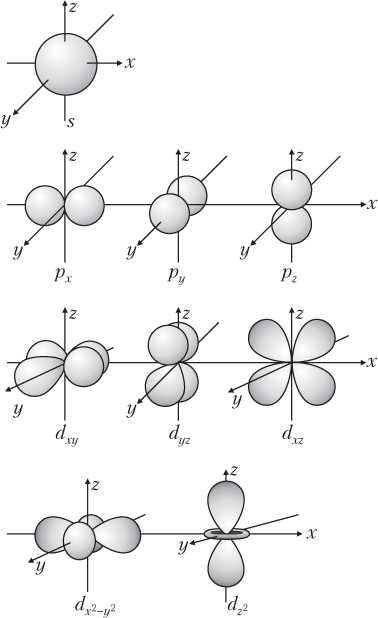
Орбитальное квантовое число l характеризует некоторые различия в энергии электронов данного энергетического уровня и пространственную форму АО (рис. 2.9). Орбитальное квантовое число принимает все целочисленные значения от 0 до n − 1, т.е. данному значению n соответствует n значений l, например:
n = 1: l = 0;
n = 2: l = 0, 1;
n = 3: l = 0, 1, 2.
Орбитальное квантовое число имеет аналог в классической физике; оно определяет орбитальный момент количества движения электрона:
,
где ℏ = h/2π (h — постоянная Планка), т.е. момент, возникающий при движении.
Число значений l равно числу энергетических подуровней, на которые расщепляется данный энергетический уровень в случае атомов с Z ≥ 1. Таким образом, первый энергетический уровень состоит из одного подуровня, второй — из двух, третий — из трех и т.д.
Энергетический подуровень можно охарактеризовать как совокупность электронных состояний с определенным набором квантовых чисел n и l.
В зависимости от значения l энергетические подуровни и отвечающие им АО имеют определенные буквенные обозначения (табл. 2.3).
| Значение l | 0 | 1 | 2 | 3 |
|---|---|---|---|---|
| Обозначение подуровня и АО | s | p | d | f |
Все АО, для которых l = 0, имеют сферическую форму, l = 1 — гантелеобразную и т.д. (см. рис. 2.9).
Состояние электрона с определенными значениями n и l записывается в виде сочетания цифры (номер энергетического уровня n) и буквенного обозначения l, например: 1s (n = 1, l = 0), 2p (n = 2, l = 1), 3d (n = 3, l = 2). Для данного энергетического уровня с увеличением значения l энергия электрона возрастает. Так, энергия 2p-подуровня выше энергии 2s-подуровня, однако различие их энергии меньше, чем для 1s- и 2s-подуровней.
Несмотря на то что каждый атом имеет бесконечное число энергетических уровней и подуровней, в образовании химических связей участвуют электроны, находящиеся на наиболее близких по энергии внешних энергетических уровнях и подуровнях, например в атомах второго периода это 2s- и 2p-электроны второго (внешнего) энергетического уровня. Переход электронов на третий энергетический уровень и вовлечение в образование химических связей 3s-, 3p- и 3d-АО затруднен из-за высокой энергии третьего энергетического уровня (энергии, выделяющейся при образовании химических связей, недостаточно для преодоления разницы энергий третьего и второго энергетического уровней).
Магнитное квантовое число m l определяет пространственную ориентацию и число АО для данного энергетического уровня: число возможных значений m l для данного l равно числу АО (см. рис. 2.9). Магнитное квантовое число принимает все целочисленные (включая нуль) значения от –l до +l, например:
l = 0: m l = 0;
l = 1: m l = −1, 0, +1;
l = 2: m l = −2, −1, 0, +1, +2.
Магнитное квантовое число также имеет классический аналог, оно определяет проекцию орбитального момента количества движения электрона М на выделенную ось z:
M l = ℏm l .
Данному значению l отвечает 2l + 1 возможных значений m l , т.е. 2l + 1 способов различной ориентации АО в пространстве. Следовательно, s-состоянию (l = 0) отвечает одна АО, p-состоянию (l = 1) — три, d-состоянию (l = 2) — пять, f-состоянию (l = 3) — семь и т.д.
Все орбитали данного подуровня в свободном атоме имеют одинаковую энергию (вырождены по энергии). Вырождение снимается при помещении атома в магнитное поле или в химическом соединении под влиянием электрических полей соседних атомов.
С учетом квантовых чисел электрона можно дать более строгое определение атомной орбитали. Атомная орбиталь — состояние электронов атома с определенным набором квантовых чисел — n, l и m l , т.е. с определенными энергией, формой и пространственной ориентацией электронного облака.
Спиновое квантовое число m s может принимать только два значения — +1/2 и −1/2. Оно не имеет аналога в классической физике. Спиновое квантовое число характеризует собственный механический момент движения электрона.
С учетом квантовых чисел электронов можно более строго рассмотреть правила построения электронных конфигураций атомов.
Число электронов, которые могут находиться на одной АО, определяется принципом Паули: в атоме не может быть даже двух электронов, имеющих все четыре одинаковых квантовых числа.
Для двух электронов, находящихся на одной и той же АО, значения n, l и m l одинаковые. Следовательно, они должны различаться значениями m s , а на одной АО не может находиться более двух электронов, так как уже для третьего электрона значение m s было бы таким же, как и для одного из двух уже находящихся на АО электронов.
С учетом принципа Паули и числа орбиталей можно определить максимальное число электронов на данном энергетическом уровне и подуровне (табл. 2.4).
Характер заполнения однотипных АО определяет правило Хунда: в пределах данного энергетического подуровня электроны заполняют АО так, чтобы их суммарный спин был максимальным.
Например, для трех электронов на 2p-подуровне:
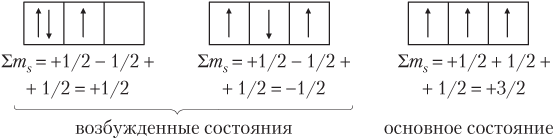
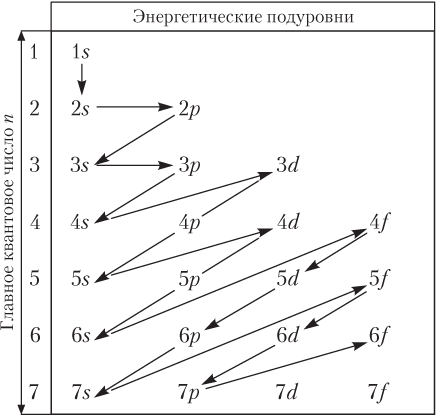
Таким образом, энергия электрона зависит от значений квантовых чисел n и l. Логично предположить, что между энергией (с одной стороны) и значениями n и l (с другой стороны) существует связь. Эту связь установил В.М. Клечковский; последовательность заполнения электронами энергетических уровней и подуровней определяется двумя правилами Клечковского.
Первое правило Клечковского: заполнение электронами орбиталей происходит в направлении возрастания суммы n + l.
Второе правило Клечковского: при одинаковом значении суммы n + l раньше заполняется подуровень с меньшим значением n.
Например, для 4s- и 3d-подуровней:
4s: n + l = 4 + 0 = 4; 3d: n + l = 3 + 2 = 5.
Поскольку для 4s-подуровня сумма n + l меньше, то он заполняется раньше (первое правило Клечковского).
В случае 3d- и 4p-подуровней:
3d: n + l = 3 + 2 = 5; 4p: n + l = 4 + 1 = 5,
т.е. суммы n + l равны, но раньше будет заполняться 3d-подуровень, для которого значение n меньше (второе правило Клечковского).
С учетом правил Клечковского последовательность заполнения электронами энергетических подуровней можно представить следующим образом:
1s → 2s → 1p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p →
→ 6s → 4f → 5d → 6p
или с помощью схемы (рис. 2.10).