Химия
Работая над систематизацией химических элементов, Д.И. Менделеев принимал во внимание два фактора: а) значения относительных атомных масс известных к тому времени 62 элементов; б) химические свойства элементов и их соединений.
Современная формулировка периодического закона: свойства атомов химических элементов, а также состав и свойства образуемых ими простых и сложных веществ находятся в периодической зависимости от зарядов ядер атомов (от атомного номера) элементов.
Датой открытия периодического закона считается 1 марта 1869 г.
Периодическая система — это графическое отображение периодического закона.
Периодический закон один, а вариантов периодических систем известно более 700. Наиболее распространен полудлинный вариант периодической системы в виде таблицы, представленный в школьном учебнике химии.
Таблица содержит семь горизонтальных рядов элементов, называемых периодами, и восемнадцать вертикальных столбцов, называемых группами.
Период — последовательный ряд химических элементов, расположенных в порядке возрастания заряда ядра атома на единицу, электронная конфигурация атомов которых изменяется от ns 1 до ns 2np 6(для первого периода от 1s 1 до 1s 2).
Физический смысл номера периода состоит в том, что он показывает число электронных слоев в атоме, т.е. число энергетических уровней в основном состоянии атома, на которых находятся электроны. Для всех элементов данного периода число электронных слоев одинаковое, а электронная конфигурация атомов — разная. Первые три периода называются малыми, остальные — большими.
Группа — вертикальный ряд элементов, сходных по химическим свойствам, что обусловлено одинаковым числом валентных электронов в их атомах.
Группы нумеруют римскими цифрами от I до VIII с добавлением букв А и В или арабскими цифрами от 1 до 18. Группы А (группы 1, 2 и 13–18) называются главными, группы В (группы 3–12) — побочными. В атомах элементов групп А происходит заполнение электронами внешнего электронного слоя (s- или p-подуровня), в атомах элементов групп В заполняется предвнешний или третий снаружи слой (d- или f-подуровень). Например:
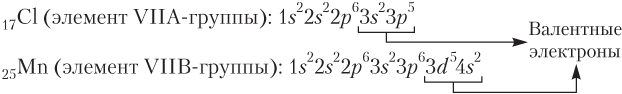
Электроны, участвующие в образовании химической связи, называются валентными. У атомов элементов групп А — это s- и p-электроны только внешнего слоя (например, в атоме хлора, элемента VIIА-группы, их 7); в атомах элементов групп В валентными могут быть и электроны предвнешнего или третьего снаружи слоя. Так, в атомах d-элементов валентными являются s-электроны внешнего слоя и d-электроны предвнешнего слоя (например, в атоме марганца общее число валентных электронов равно 2 + 5 = 7, что совпадает с номером группы).
Таким образом, физический смысл номера группы состоит в том, что он, как правило, равен числу валентных электронов в атоме.
В атомах элементов одной группы число валентных электронов одинаковое, что, как уже отмечалось, и является причиной подобия их химических свойств.
Зигзагообразная линия, проведенная в периодической таблице от бора до астата, отделяет элементы-металлы (они расположены левее этой линии) от неметаллов (расположены справа вверху от разделительной линии, включая водород).
Неметаллов всего 23. Элементы, расположенные вблизи граничной линии (бор, кремний, германий, мышьяк, теллур), иногда называют полуметаллами.










