Химия
По способности проводить ток в водном растворе или расплавленном состоянии вещества делятся на две группы: электролиты и неэлектролиты.
Электролиты — вещества, водные растворы или расплавы которых проводят электрический ток. Неэлектролиты — это вещества, водные растворы или расплавы которых электрический ток не проводят.
В отличие от металлов (проводники первого рода, электрический ток проводят за счет свободных электронов), электролиты проводят электрический ток за счет свободно движущихся ионов, поэтому называются проводниками второго рода. Примеры электролитов: KCl, NH4NO3, KOH, H2SO4, CH3COOK, HNO3, H2O. Примеры неэлектролитов: бензол, сахароза, альдегиды, спирты, азот, кислород, водород, углеводороды.
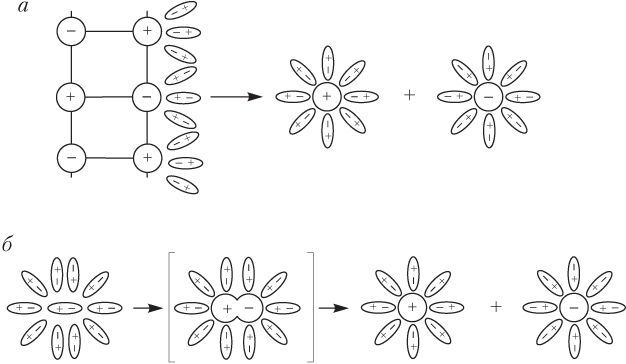
Ионы в электролитах существуют либо изначально (ионные кристаллы: соли, щелочи), либо появляются вследствие взаимодействия полярных молекул вещества с диполями воды (рис. 11.1).
В случае ионных кристаллов роль воды в диссоциации состоит в разрушении кристалла (рис. 11.1, а) и переводе ионов вещества в состояние подвижных гидратированных ионов. Для полярных молекул вода непосредственно участвует в образовании первоначально отсутствующих ионов.
Процесс распада (диссоциации) вещества на подвижные ионы называется электролитической диссоциацией. Основы теории электролитической диссоциации заложил С. Аррениус (1887).
В расплавах диссоциация происходит под действием температуры: при нагревании ионных кристаллов возрастает энергия колебания ионов в узлах кристаллической решетки, что в конце концов приводит к ее разрушению и образованию подвижных ионов.
Пренебрегая активной ролью воды в процессе, уравнение электролитической диссоциации записывают как распад вещества на свободные (подвижные) ионы (обычно вместо знака равно используют стрелку →):
KOH → K+ + OH−
HCl → H+ + Cl−
(на самом деле в водных растворах катион H+ не существует, а образуются ионы H3O+: H+ + H2O = H3O+)
Под действием постоянного электрического тока положительно заряженные ионы направляются к отрицательно заряженному электроду (катоду), поэтому их называют катионами; отрицательно заряженные ионы, которые устремляются к положительно заряженному электроду (аноду), называются анионами. Благодаря такому направленному движению ионов электролиты и проводят электрический ток.
Ионы по физическим, химическим и физиологическим свойствам отличаются от нейтральных атомов, из которых они образовались. Например, ионы калия K+ и хлорид-ионы Cl− не имеют цвета, запаха, не ядовиты. Атомы калия энергично взаимодействуют с водой. Вещество хлор Cl2 — это газ желто-зеленого цвета, ядовит, сильный окислитель.










