Химия
Количественно диссоциация характеризуется степенью электролитической диссоциации.
Степень электролитической диссоциации α — это отношение числа продиссоциировавших (распавшихся) на ионы молекул или формульных единиц (ФЕ) к общему числу растворенных молекул (ФЕ):
. (11.1)
Степень диссоциации можно выразить через химическое количество и через молярную концентрацию:
. (11.2)
Пример 11.1. Из 250 внесенных в раствор молекул электролита на ионы распалось 30. Найдите степень диссоциации электролита.
Решение. Используя формулу (11.1), находим:
(12 %).
Ответ: 12 %.
Численное значение α позволяет классифицировать электролиты на сильные и слабые. Сильными называются электролиты, которые в водных растворах или расплавах практически полностью распадаются на ионы; понятно, что для таких электролитов α ≈ 1 (100 %). Для слабых электролитов α < 1 (100 %), слабые электролиты диссоциируют лишь частично (табл. 11.1).
К числу слабых электролитов относится вода
| Вещества | Характеристика электролитов | |
|---|---|---|
| Сильные | Слабые | |
| Кислоты | HI, HBr, HCl, HNO3, H2SO4 (разб), HClO3, HClO4, HMnO4 | HF, HClO, HClO2, H2S,H2Se, H2CO3, H2SO3, H3AsO4, H3PO4, H2SiO3, HNO2, CH3COOH, HCOOH, C6H5COOH, HCN, H3BO3, H2SO4 (конц) |
| Основания, амфотерные гидроксиды | Щелочи: LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2 | Все нерастворимые: Mg(OH)2, Fe(OH)2, Cu(OH)2, все амфотерные гидроксиды (Be(OH)2, Cr(OH)3, Al(OH)3), гидрат аммиака NH3 ⋅ H2O |
| Соли | Подавляющее большинство | Некоторые галогениды ртути, сурьмы, висмута, кадмия и цинка |
К слабым электролитам также относятся гидроанионы слабых кислот (HS–, , , , ), гидроксокатионы слабых оснований (CuOH+, MgOH+, , , AlOH2+, ZnOH+), а также комплексные ионы [Al(OH)6]3−, [Zn(OH)4]2−, [Be(OH)4]2−.
Пример 11.2. Укажите формулы неэлектролитов: а) K2SO4; б) H2O; в) CH3OH; г) C6H14.
1) б, в, г;
2) а, в, г;
3) в, г;
4) а, г.
Решение. Неэлектролитами являются спирты (CH3OH) и алканы (C6H14). Вода — электролит (хотя и слабый), K2SO4 — соль, сильный электролит.
Ответ: 3).
Пример 11.3. В растворе кислоты HАn общее число ионов кислоты в 5 раз меньше, чем нераспавшихся молекул HAn. Найдите степень диссоциации (%) кислоты.
Решение. Записываем уравнение диссоциации кислоты и проводим расчеты:
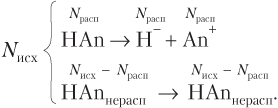
Так как N(H+) = N(An−) = N расп(HAn), имеем:
или .
Откуда находим
N исх = 11N расп;
α = N расп/N исх = N расп/11N расп = 0,091 (9,1 %).
Ответ: 9,1 %.










