Химия
Растворимость веществ, т.е. способность растворяться в том или ином растворителе, различается; качественно по способности растворяться вещества можно разделить:
- на хорошо растворимые (больше 1 г вещества в 100 г растворителя);
- малорастворимые (0,1–1,0 г вещества в 100 г растворителя);
- нерастворимые (меньше 0,1 г вещества в 100 г растворителя).
Однако следует иметь в виду, что абсолютно нерастворимых веществ в природе нет. Например, погруженная в воду серебряная монета частично поставляет в раствор ионы Ag+, благодаря чему вода приобретает целебные свойства.
Количественно растворимость характеризуют содержанием растворенного вещества в насыщенном растворе. Это содержание выражают с помощью коэффициента растворимости или массовой доли насыщенного раствора.
Коэффициент растворимости s (k) равен максимальной массе вещества (в г), которое можно растворить в данных условиях в 100 г (реже — в 1 дм3) растворителя; в случае газов растворимость часто задают в кубических сантиметрах (или граммах) на 1 дм3: см3/дм3 или г/дм3.
Рассмотрим факторы, влияющие на растворимость веществ.
Прежде всего, растворимость зависит от природы растворяемого вещества и растворителя. Согласно известному правилу — подобное растворяется в подобном. Это означает, что энергия взаимодействия между частицами растворяемого вещества должна быть близка к энергии межмолекулярных сил в растворителе. Вода как полярный растворитель лучше растворяет ионные вещества или вещества молекулярного строения с полярными молекулами: соли, щелочи, галогеноводороды, серная кислота и др.; в то же время неполярные алканы, бензол в воде плохо растворимы. Напротив, хорошими растворителями неполярных веществ являются керосин, бензин, состоящие из неполярных молекул углеводородов; имеющий неполярные молекулы иод лучше растворим в бензоле, чем в воде. Растворимость веществ в воде возрастает, если они химически взаимодействуют с водой (SO3, P2O5, Na2O и др.) или образуют с ней водородные связи (спирты, аммиак, фтороводород, пероксид водорода).
Растворимость веществ зависит от температуры и подчиняется принципу Ле Шателье. Так, растворение газов — процесс чаще всего экзотермический, поскольку при растворении газов практически отсутствуют затраты энергии на разрыв связей между молекулами газа:
.
Согласно принципу Ле Шателье, понижение температуры сместит это равновесие вправо, а повышение — влево. Таким образом, при повышении температуры растворимость газов в воде понижается, а при понижении температуры — возрастает.
По этой причине реки в северных широтах содержат больше кислорода и, следовательно, более богаты рыбой.
Повышение температуры на растворимость жидкостей влияет по-разному: иногда при нагревании жидкости смешиваются неограниченно, а иногда расслаиваются. В большинстве же случаев при повышении температуры взаимная растворимость жидкостей возрастает, вплоть до неограниченного по массе смешивания.
В случае твердых веществ влияние температуры на растворимость может быть различным (рис. 10.3); в большинстве случаев с ростом
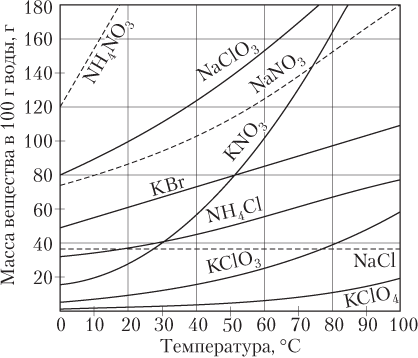
температуры раствормость твердых веществ возрастает, однако растворимость Ca(OH)2, CaCO3, CaSO4 уменьшается. Растворимость NaCl от температуры зависит слабо.
На растворимость газов влияет давление. При растворении твердых веществ в жидкостях (или жидкости в жидкости) объем существенно не изменяется, поэтому изменение давления на растворимость в этом случае практически не влияет. Растворение газа в жидкости всегда сопровождается уменьшением объема, поэтому в случае газов повышение давления увеличивает их растворимость в жидкостях, а понижение давления, наоборот, уменьшает.
Растворимость не следует путать со скоростью растворения. Например, растворимость кускового сахара и сахарного песка одинаковые, однако насыщенный раствор сахара в воде быстрее образуется в случае сахара-песка (сахар-песок растворяется быстрее, так как в этом случае больше поверхность соприкосновения растворителя и растворяемого вещества). Повышению скорости растворения твердого вещества в жидкости способствует перемешивание, однако на растворимость оно не влияет.
Отметим, что не для всяких веществ можно получить насыщенные растворы. Есть вещества, растворимость которых в воде неограниченна: метанол, этанол, пропанол-1 и пропанол-2, уксусная, серная, муравьиная, пропановая и азотная кислоты, этаналь, этиленгликоль, глицерин.
Для растворов веществ, неограниченно смешивающихся с водой, понятия «насыщенный» и «ненасыщенный» не применимы (нельзя, например, говорить: насыщенный раствор серной кислоты). Очевидно, понятия «разбавленный» и «концентрированный» для веществ, неограниченно растворяющихся в воде, применимы
Пример 10.3. При температуре 40 °С растворимость вещества (в г на 100 г H2O) составляет 75 г, а при 0 °С — 45,2 г. Укажите формулу вещества:
1) AgCl;
2) NH3;
3) CH3OH;
4) AgF.
Решение. Этим веществом не может быть аммиак (газ), так как его растворимость с понижением температуры увеличивается. Растворимость вещества достаточно высока, поэтому это не может быть AgCl (нерастворимая в воде соль). Искомым веществом не может быть метанол CH3OH, поскольку он неограниченно растворяется в воде. Следовательно, имеется в виду AgF.
Ответ: 4).
Пример 10.4. Наименьшее влияние на скорость растворения оксида цинка в соляной кислоте оказывает:
1) изменение температуры;
2) степень измельчения цинка;
3) повышение концентрации кислоты;
4) изменение давления.
Решение. Реакция, уравнение которой
ZnO(тв) + 2HCl (р-р) = ZnCl2 (р-р) + H2O (ж),
протекает без участия газов, поэтому наименьшее влияние на ее скорость оказывает изменение давления.
Ответ: 4).










