Химия
Многие химические реакции обратимы, т.е. протекают в двух противоположных направлениях, например:
- синтез аммиака
N2 + 3H2 2NH3
- синтез оксида серы(VI)
2SO2 + O2 2SO3
- гидролиз солей
K2S + HOH ⇄ KHS + KOH
- реакция этерификации
CH3COOH + C2H5OH CH3COOC2H5 + H2O
- диссоциация слабой кислоты
CH3COOH ⇄ CH3COO− + H+
- диссоциация слабого основания
NH3 · H2O ⇄ + OH−
В течении любой обратимой реакции наступает состояние, когда скорости прямой и обратной реакций становятся равными. Такое состояние называется химическим равновесием.
Количественно химическое равновесие характеризуется константой равновесия. Выведем математическое выражение константы равновесия K для обратимого гомофазного процесса
аА + bВ ⇄ f F + dD
через равновесные молярные концентрации реагентов и продуктов реакции. В состоянии равновесия скорость прямой
v пр = k пр · c a (A) · c b (B)
и обратной реакции
v обр = k обр · c f (F) · c d (D)
равны, т.е.
k пр · c a (A) · c b (B) = k обр · c f (F) · c d (D).
Отсюда получаем:
.
Поскольку константы скоростей прямой и обратной реакций — величины постоянные, то и их отношение в состоянии равновесия также величина постоянная и называется константой равновесия:
.
Так, для состояния равновесия реакций синтеза аммиака и диссоциации уксусной кислоты (в данном случае константу равновесия называют константой диссоциации и обозначают буквой K д) выражения констант равновесия имеют вид:
.
Значение константы равновесия зависит от температуры и природы веществ, но не зависит от их концентрации, а также давления и присутствия катализатора. Покажем это.
Допустим, что после достижения реакцией синтеза аммиака состояния равновесия (v пр = v обр) повысили концентрацию одного из исходных веществ, например водорода. Скорость прямой реакции при этом возрастет и равновесие сместится в сторону образования аммиака (вправо). Однако со временем исходные вещества расходуются, их концентрация будет уменьшаться, а концентрация продукта реакции (аммиака) возрастать. Следовательно, со временем прямая реакция замедляется, а скорость обратной реакции, напротив, возрастает. Через некоторый промежуток времени их скорости сравняются () и наступит новое равновесие. В состоянии нового равновесия скорости прямой и обратной реакций несколько выше, чем те, что были до добавления водорода, однако отношение , т.е. константа равновесия, не изменится (рис. 9.7).
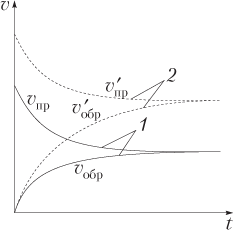
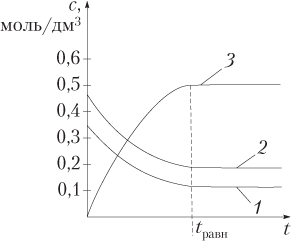
Подчеркнем, что в состоянии равновесия равны скорости прямой и обратной реакций, но не молярные концентрации (или масса) исходных веществ и продуктов реакции. Для обратимой гомогенной реакции H2 + I2 ⇄ 2HI это показано на рис. 9.8 с начальными концентрациями (моль/дм3) H2 и I2 соответственно 0,45 и 0,35.
Численное значение константы равновесия характеризует выход продуктов реакции: чем больше значение константы равновесия, тем больше выход продуктов, тем полнее исходные вещества превращаются в продукты реакции. Если K > 1, то равновесие смещено вправо.
Константы равновесия реакций электролитической диссоциации (K д) слабых кислот и слабых оснований лучше подходят для оценки силы слабого электролита, чем значения степеней диссоциации α, поскольку не зависят от концентрации электролита (при разбавлении раствора α уменьшается).
Для всех слабых кислот K д << 1 (табл. 9.2) и сила кислот сверху вниз уменьшается (уменьшается значение K д); каждая вышестоящая кислота вытесняет из солей все нижерасположенные, например:
С6H5ONa + H2O + CO2 = C6H5OH + NaHCO3
2CH3COOH + K2S = 2CH3COOK + H2S
| Формула | K 1 | K 2 |
|---|---|---|
| CCl3COOH | 2,2 · 10−2 | — |
| H2SO3 | 2,0 · 10−2 | 6,3 · 10−8 |
| H3PO4 | 7,2 · 10−3 | 6,2 · 10−8 |
| HF | 6,7 · 10−4 | — |
| HNO2 | 5,1 · 10−4 | — |
| HCOOH | 1,8 · 10−4 | — |
| CH3COOH | 1,7 · 10−5 | — |
| H2CO3 | 4,3 · 10−7 | 4,7 · 10−11 |
| H2S | 1,1 · 10−7 | 1,2 · 10−13 |
| HClO | 2,8 · 10−8 | — |
| HCN | 4,9 · 10−10 | — |
| H2SiO3 | 1,6 · 10−10 | 1,9 · 10−12 |
| C6H5OH | 1,0 · 10−10 | — |
| H2O | 1,8 · 10−10 | — |
| C2H5OH | 2,3 · 10−11 | — |
Из данных таблицы следует, что для многоосновной кислоты каждая последующая стадия диссоциации примерно в 104–105 раз слабее предыдущей. Вода — тоже электролит, но очень слабый. Кислотные свойства алканолов (этанол) выражены слабее, чем у воды.
Связь степени электролитической диссоциации α и константы диссоциации для слабых электролитов определяется формулой Оствальда:
,
откуда .
Например, для Н3РО4 (с = 0,1 моль/дм3) для первой стадии диссоциации
(≈ 30 %).
Таким образом, из каждых 100 молекул Н3РО4 на первой стадии диссоциируют только 30 молекул.
Для обратимой гетерогенной реакции константа равновесия не зависит от содержания вещества, находящегося в твердой фазе. Например, для процесса
CO2 (г) + C (тв) ⇄ 2CO (г)
.
Рассмотрим влияние температуры на константу равновесия. Напомним, что сильнее от температуры выражена зависимость скорости эндотермической реакции, для которой энергия активации всегда больше, чем для экзотермической реакции.
Допустим, что после достижения состояния равновесия
N2O4 (г) ⇄ 2NO2 (г) − Q
в системе повысили температуру от Т 1 до Т 2 и поддерживают ее постоянной. При этом возрастет скорость как прямой, так и обратной реакции, но в прямой в большее число раз, поскольку она является эндотермической. В результате равновесие сместится вправо, т.е. концентрация N2O4 будет уменьшаться, а NO2 — возрастать. Поэтому со временем скорость прямой реакции будет уменьшаться, а обратной — увеличиваться. Наступит момент, когда v пр = v обр и будет достигнуто новое равновесие. В результате образуется новая равновесная смесь, отвечающая большему значению константы равновесия, поскольку при повышении температуры возросли константы скорости k пр и k обр (в большей степени — k пр). При этом в новой равновесной смеси концентрация NO2 будет большей, чем в исходной, а концентрация N2O4 — меньшей.
При понижении температуры равновесие смещается вправо, константа равновесия уменьшается, и в новой равновесной смеси концентрация NO2 будет меньше, чем в исходной, а концентрация N2O4 — больше.
Таким образом, повышение или понижение температуры приводит соответственно к увеличению или уменьшению константы равновесия.
Как уже отмечалось, катализатор на состояние химического равновесия не влияет, поскольку в одинаковой мере уменьшает энергию активации и прямой, и обратной реакций. В присутствии катализатора равновесие наступает быстрее, как это показано на рис. 9.9 (штрих-пунктирные кривые описывают зависимость концентрации от времени для некаталитической реакции) в случае обратимого гомогенного процесса А ⇄ В.
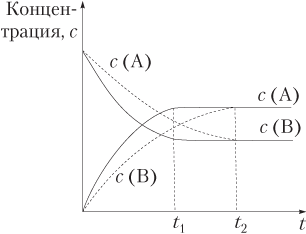
Таким образом, использование катализатора в обратимом процессе не позволяет увеличить выход продукта.










