Химия
Смеси веществ бывают однородными и неоднородными (см. гл. 1).
Взвеси — неоднородные (гетерогенные) смеси, или, как говорят, дисперсные системы с довольно крупными d ≥ 100 мкм (1 мкм = = 10−6 м) частицами, взвешенными в жидкости или газе (рис. 10.1).
Взвеси делятся на суспензии, эмульсии, пены и аэрозоли.
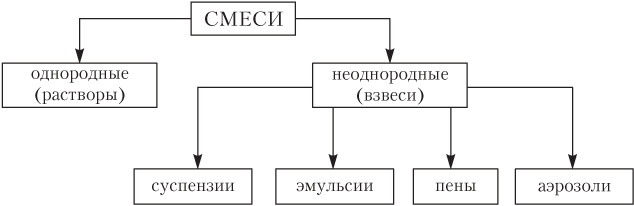
Суспензия — это смесь твердых веществ в жидкости (например, мела или глины в воде). При отстаивании частицы взвеси оседают на дно сосуда; частицы твердого вещества от жидкости можно отделить фильтрованием.
Эмульсия — смесь (взвесь) двух или более взаимно нерастворимых жидкостей (смесь масла или керосина с водой, молоко, сливочное масло, краски). При отстаивании некоторых эмульсий происходит их расслоение (смесь подсолнечного масла и воды), многие эмульсии (особенно при добавлении специальных стабилизаторов — эмульгаторов) достаточно устойчивы (майонез, крем, масло, краски).
Пена — это смесь газа и жидкости (газированная вода, пиво, квас, шампуни, мыльная пена). Устойчивость обычных пен, как правило, невысока. Известны твердые пены — смеси газов и твердых веществ (газ + стекло, газ + алюминий). Твердые пены обладают жестким каркасом, они очень устойчивые, имеют пористую структуру и малую плотность при высокой тепло- и звукоизолирующей способности (пенопласты, пористые резины, пеногазобетон, пеностекла).
Аэрозоль — это взвесь жидких или твердых веществ в газах. Такие взвеси с жидкими частицами называются туманом, с твердыми частицами — пылью, с твердыми и жидкими — дымом (смогом).
Характерная особенность взвесей — неустойчивость во времени, кроме того, отдельные компоненты таких смесей при смешивании не изменяют своих свойств.
Растворы — однородные (гомогенные) устойчивые системы переменного состава, состоящие из двух или более компонентов и продуктов их взаимодействия. Например, компонентами раствора серной кислоты в воде будут H2O и H2SO4, а продуктами их взаимодействия — гидратированные ионы H+, , .
Переменный состав раствора означает, что соотношение количеств веществ в растворе можно непрерывно менять в определенных пределах.
В любой точке объема состав раствора одинаковый, так как в растворе частицы растворенного вещества — это отдельные молекулы или ионы, которые нельзя заметить даже с использованием микроскопа (такие растворы иногда называют истинными). Отметим также, что растворы образуются самопроизвольно, достаточно просто смешать вещество и растворитель.
В растворе различают растворитель и растворенное вещество (вещества). Растворителем считается компонент, который в индивидуальном состоянии (до смешивания) имеет то же агрегатное состояние, что и раствор, тогда как растворяемое вещество может быть твердым, жидким или газообразным. Если один из компонентов раствора — вода, то ее обычно и считают растворителем независимо от массовых соотношений веществ в растворе (например, раствор с массовой долей азотной кислоты 65 % принято считать раствором азотной кислоты в воде, а не наоборот). В других случаях при одинаковом агрегатном состоянии растворителем считают тот компонент, масса которого в растворе больше.
По агрегатному состоянию растворы делят на жидкие, твердые и газообразные. Примерами твердых растворов являются сплавы металлов, газообразных — воздух. Наиболее распространенные и важные в практическом отношении — жидкие растворы, среди которых различают водные (растворитель — вода) и неводные (растворитель — спирт, бензол, ацетон и др.).
Растворы по своим характеристикам занимают промежуточное положение между взвесями и химическими соединениями. Подобно химическим соединениям растворы устойчивые и однородные. Растворитель и растворенное вещество химически взаимодействуют между собой. На это указывают:
- тепловой эффект при образовании растворов;
- явление контракции — сокращение объема при смешивании жидкостей. Например, при смешивании 1 дм3 воды и 1 дм3 этанола суммарный объем раствора равен не 2 дм3, а 1,93 дм3;
- изменение окраски при образовании жидких растворов (раствор бесцветных кристаллов сульфата меди(II) в воде имеет синий цвет из-за образования гидратированных ионов Cu2+ · 4H2O);
- изменение свойств веществ при образовании растворов (то же происходит при образовании химических соединений).
Подобно неоднородным смесям растворы:
- не подчиняются закону постоянства состава;
- могут быть разделены на отдельные компоненты сравнительно простыми способами (например, дистилляцией).
Таким образом, растворы можно рассматривать как физико-химические системы.
Процесс растворения вещества — это также физико-химическое явление. В процессе растворения различают:
1) физическую сторону:
- разрыв связей между ионами в ионном кристалле или межмолекулярных связей в веществах молекулярного строения;
- диффузию частиц уже растворенного вещества (молекул или ионов) в объеме растворителя;
2) химическую сторону: взаимодействие молекул растворителя с частицами растворенного вещества, которое называется сольватацией. Когда растворителем является вода, такое взаимодействие молекул воды с частицами растворенного вещества называется гидратацией. Гидратация приводит к образованию гидратов, например: H2SO4 ⋅ H2O, NH3 ⋅ 2H2O.
Гидратную теорию растворов предложил Д.И. Менделеев. Обычно гидраты неустойчивы и существуют только в растворах, но в отдельных случаях устойчивость гидратов так высока, что выпариванием или охлаждением их можно выделить из водных растворов в виде кристаллов.
Кристаллогидраты — кристаллы, в образовании которых участвуют молекулы воды. Вода, которая входит в состав кристаллогидратов, называется кристаллизационной. Некоторые кристаллогидраты имеют тривиальные (технические) названия (табл. 10.1).











