Химия
Большинство химических реакций являются обратимыми, т.е. одновременно протекают как в сторону образования продуктов, так и в сторону их распада (слева направо и справа налево).
Примеры уравнений реакций обратимых процессов:
N2 + 3H2 2NH3
2SO2 + O2 2SO3
H2 + I2 2HI
Обратимые реакции характеризуются особым состоянием, которое называется состоянием химического равновесия.
Химическое равновесие — это такое состояние системы, при котором скорости прямой и обратной реакций становятся равными. При движении к химическому равновесию скорость прямой реакции и концентрация реагентов уменьшаются, а обратной и концентрации продуктов — возрастают.
В состоянии химического равновесия в единицу времени образуется столько продукта, сколько и распадается. В результате концентрации веществ, находящихся в состоянии химического равновесия, со временем не изменяются. Однако это вовсе не означает, что равновесные концентрации или массы (объемы) всех веществ обязательно равны между собой (см. рис. 9.8 и 9.9). Химическое равновесие — это динамическое (подвижное) равновесие, которое может откликаться на внешнее воздействие.
Переход равновесной системы из одного равновесного состояния в другое называется смещением или сдвигом равновесия. На практике говорят о смещении равновесия в сторону продуктов реакции (вправо) или в сторону исходных веществ (влево); прямой называют реакцию, протекающую слева направо, а обратной — справа налево. Состояние равновесия показывают двумя противоположно направленными стрелками: ⇄.
Принцип смещения равновесия был сформулирован французским ученым Ле Шателье (1884): внешнее воздействие на систему, находящуюся в равновесии, приводит к смещению этого равновесия в направлении, ослабляющем эффект внешнего воздействия
Сформулируем основные правила смещения равновесия.
Влияние концентрации: при увеличении концентрации вещества равновесие смещается в сторону его расходования, а при уменьшении — в сторону его образования.
Например, при увеличении концентрации H2 в обратимой реакции
H2 (г) + I2 (г) ⇄ 2HI (г)
скорость прямой реакции, зависящей от концентрации водорода, увеличится. В результате равновесие сместится вправо. При уменьшении концентрации H2 скорость прямой реакции уменьшится, в результате равновесие процесса сместится влево.
Влияние температуры: при повышении температуры равновесие смещается в сторону эндотермической реакции, а при понижении — в сторону экзотермической реакции.
Важно помнить, что при увеличении температуры возрастает скорость как экзо-, так и эндотермической реакции, но в большее число раз — эндотермической реакции, для которой Е а всегда больше. При уменьшении температуры уменьшается скорость обеих реакций, но опять же в большее число раз — эндотермической. Сказанное удобно проиллюстрировать схемой, на которой значение скорости пропорционально длине стрелок, а равновесие смещается в направлении более длинной стрелки.
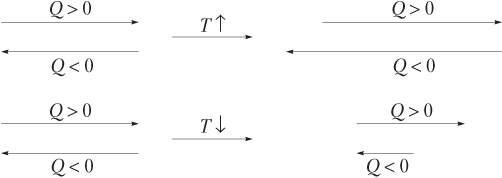
Влияние давления: изменение давления влияет на состояние равновесия только в том случае, когда в реакции принимают участие газы, и даже тогда, когда газообразное вещество находится только в одной части химического уравнения. Примеры уравнений реакций:
- давление влияет на смещение равновесия:
3H2 (г) + N2 (г) ⇄ 2NH3 (г),
CaO (тв) + CO2 (г) ⇄ CaCO3 (тв);
- давление не влияет на смещение равновесия:
Cu (тв) + S (тв) = CuS (тв),
NaOH (р-р) + HCl (р-р) = NaCl (р-р) + H2O (ж).
При уменьшении давления равновесие смещается в сторону образования большего химического количества газообразных веществ, а при увеличении — в сторону образования меньшего химического количества газообразных веществ. Если химические количества газов в обеих частях уравнения одинаковые, то давление не оказывает влияния на состояние химического равновесия:
H2 (г) + Cl2 (г) = 2HCl (г).
Сказанное легко понять, учитывая, что действие изменения давления аналогично действию изменения концентрации: при увеличении давления в n раз во столько же раз возрастает и концентрация всех веществ, находящихся в равновесии (и наоборот).
Влияние объема реакционной системы: изменение объема реакционной системы связано с изменением давления и оказывает влияние только на состояние равновесия реакций с участием газообразных веществ. Уменьшение объема означает увеличение давления и смещает равновесие в сторону образования меньшего химического количества газов. Увеличение объема системы приводит к уменьшению давления и смещению равновесия в сторону образования большего химического количества газообразных веществ.
Введение в равновесную систему катализатора или изменение его природы не смещает равновесие (не увеличивает выход продукта), так как катализатор в одинаковой степени ускоряет и прямую, и обратную реакции. Это связано с тем, что катализатор в равной мере уменьшает энергию активации прямого и обратного процессов. Тогда зачем же в обратимых процессах используют катализатор? Дело в том, что использование катализатора в обратимых процессах способствует быстрейшему наступлению равновесия, а это увеличивает эффективность промышленного производства.
Конкретные примеры влияния различных факторов на смещение равновесия приведены в табл. 9.1 для реакции синтеза аммиака, протекающей с выделением теплоты. Иными словами, прямая реакция экзотермическая, а обратная — эндотермическая.
| Фактор воздействия на равновесную систему | Направление смещения равновесия реакции |
|---|---|
| Увеличение концентрации водорода, c(H2)↑ | Равновесие смещается вправо, система отвечает уменьшением c(H2) |
| Уменьшение концентрации аммиака, c(NH3)↓ | Равновесие смещается вправо, система отвечает увеличением c(NH3) |
| Увеличение концентрации аммиака, c(NH3)↑ | Равновесие смещается влево, система отвечает уменьшением c(NH3) |
| Уменьшение концентрации азота, c(N2)↓ | Равновесие смещается влево, система отвечает увеличением c(N2) |
| Сжатие (уменьшение объема, повышение давления) | Равновесие смещается вправо, в сторону уменьшения объема газов |
| Расширение (увеличение объема, понижение давления) | Равновесие смещается влево, в сторону увеличения объема газа |
| Повышение давления | Равновесие смещается вправо, в сторону меньшего объема газа |
| Понижение давления | Равновесие смещается влево, в сторону большего объема газов |
| Повышение температуры | Равновесие смещается влево, в сторону эндотермической реакции |
| Понижение температуры | Равновесие смещается вправо, в сторону экзотермической реакции |
| Внесение катализатора | Равновесие не смещается |
Пример 9.3. В состоянии равновесия процесса
2SO2 (г) + O2 (г) ⇄ 2SO3 (г)
концентрации веществ (моль/дм3) SO2, O2 и SO3 соответственно равны 0,6, 0,4 и 0,2. Найдите исходные концентрации SO2 и O2 (исходная концентрация SO3 равна нулю).
Решение. В ходе реакции SO2 и O2 расходуются, поэтому
c исх (SO2) = c равн (SO2) + c израсх (SO2),
c исх (O2) = c равн (O2) + c израсх (O2).
Значение c израсх находим по c(SO3):
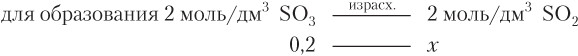
x = 0,2 моль/дм3.
Поэтому
c исх (SO2) = 0,6 + 0,2 = 0,8 (моль/дм3).
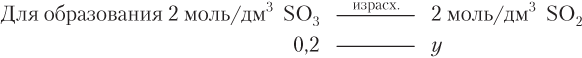
y = 0,1 моль/дм3.
Поэтому
c исх(O2) = 0,4 + 0,1 = 0,5 (моль/дм3).
Ответ: 0,8 моль/дм3 SO2; 0,5 моль/дм3 O2.
При выполнении экзаменационных заданий часто путают влияние различных факторов, с одной стороны, на скорость реакции, а с другой — на смещение химического равновесия.
Для обратимого процесса
при повышении температуры возрастает скорость как прямой, так и обратной реакции; при понижении температуры уменьшается скорость как прямой, так и обратной реакции;
при повышении давления возрастают скорости всех реакций, протекающих с участием газов, — и прямой, и обратной. При понижении давления уменьшается скорость всех реакций, протекающих с участием газов, — и прямой, и обратной;
введение в систему катализатора или его замена на другой катализатор равновесие не смещают.
Пример 9.4. Протекает обратимый процесс, описываемый уравнением
N2 (г) + 3H2 (г) ⇄ 2NH3 (г) + Q
Рассмотрите, какие факторы: 1) увеличивают скорость синтеза реакции аммиака; 2) смещают равновесие вправо:
а) понижение температуры;
б) повышение давления;
в) уменьшение концентрации NH3;
г) использование катализатора;
д) увеличение концентрации N2.
Решение. Увеличивают скорость реакции синтеза аммиака факторы б), г) и д) (а также повышение температуры, увеличение концентрации Н2); смещают равновесие вправо — а), б), в), д).
Ответ: 1) б, г, д; 2) а, б, в, д.
Пример 9.5. Ниже приведена энергетическая схема обратимой реакции
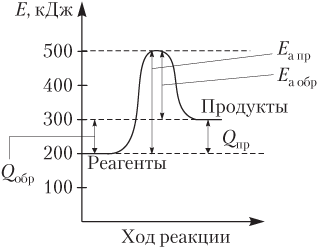
Укажите все справедливые утверждения:
а) обратная реакция протекает быстрее, чем прямая;
б) с повышением температуры скорость обратной реакции возрастает в большее число раз, чем прямой реакции;
в) прямая реакция протекает с поглощением теплоты;
г) величина температурного коэффициента γ больше для обратной реакции.
Решение.
а) Утверждение верное, так как Е а обр = 500 − 300 = 200 (кДж) меньше Е а пр = 500 − 200 = 300 (кДж).
б) Утверждение неверное, в большее число раз возрастает скорость прямой реакции, для которой Е а больше.
в) Утверждение верное, Q пр = 200 − 300 = −100 (кДж).
г) Утверждение неверное, γ больше для прямой реакции, в случае которой больше Е а.
Ответ: а), в).










