Химия
Оксиды — сложные вещества, состоящие из двух элементов, один из которых — атом кислорода в степени окисления −2. Общая формула оксидов может быть представлена как ЭО x /2, где х — степень окисления атома элемента.
По способности образовывать соли в реакциях с соединениями других классов оксиды делят на солеобразующие и несолеобразующие (CO, SiO, NO, N2O). Солеобразующие оксиды, в свою очередь, классифицируют на основные, кислотные и амфотерные. Осно́вными называются оксиды, которым соответствуют основания, кислотными — оксиды, которым отвечают кислоты. К амфотерным относятся оксиды, проявляющие химические свойства как основных, так и кислотных оксидов.
Основные оксиды образуют только элементы металлы: щелочные (Li2O, Na2O, K2O, Cs2O, Rb2O), щелочноземельные (CaO, SrO, BaO, RaO) и магний (MgO), а также металлы d-семейства в степени окисления +1, +2, реже +3 (Cu2O, CuO, Ag2O, CrO, FeO, MnO, CoO, NiO, Sc2O3).
Кислотные оксиды образуют как элементы неметаллы (CO2, SO2, NO2, P2O5, Cl2O7), так и элементы металлы, причем в последнем случае степень окисления атома металла должна быть +5 и выше (V2O5, CrO3, Mn2O7, MnO3, Sb2O5, OsO4). Амфотерные оксиды образуют, как правило, элементы металлы (ZnO, Al2O3, Fe2O3, BeO, Cr2O3, PbO, SnO, MnO2).
Оксиды металлов в степени окисления +5 и выше являются кислотными и имеют молекулярное строение.
В обычных условиях оксиды могут находиться в трех агрегатных состояниях: все основные и амфотерные оксиды — твердые вещества, кислотные оксиды могут быть жидкими (SO3, Cl2O7, Mn2O7), газообразными (CO2, SO2, NO2) и твердыми (P2O5, SiO2). Некоторые имеют запах (NO2, SO2), однако большинство оксидов запаха не имеют. Одни оксиды окрашены: бурый NO2, вишнево-красный CrO3, черные CuO и Ag2O, красные Cu2O и HgO, коричневый Fe2O3, белые SiO2, Al2O3 и ZnO, другие — бесцветные (H2O, CO2, SO2). Большинство оксидов устойчивы при нагревании; легко разлагаются при нагревании оксиды ртути и серебра.
Основные и амфотерные оксиды имеют немолекулярное строение, для них характерна кристаллическая решетка ионного типа. Большинство кислотных оксидов — вещества молекулярного строения (одно из немногих исключений — оксид кремния(IV), имеющий атомную кристаллическую решетку). Примеры графических формул кислотных оксидов (для оксидов немолекулярного строения приводить графические формулы не рекомендуется):
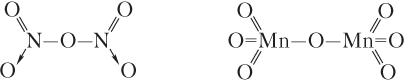
В соответствии с международной номенклатурой степень окисления элемента в названии оксида указывают только в том случае, если она для данного элемента может быть переменной: оксид углерода(II) CO, оксид железа(III) Fe2O3, оксид хлора(I) Cl2O, оксид марганца(VII) Mn2O7.
Широко используются тривиальные названия оксидов: угарный газ CO, углекислый газ CO2, сернистый газ SO2, песок (кварц, кремнезем) SiO2. Кислотные оксиды иногда называют ангидридами кислот, например SO3 — ангидрид серной кислоты (серный ангидрид), P2O5 — ангидрид фосфорной кислоты (фосфорный ангидрид).
Характер изменения кислотно-основных свойств оксидов элементов в зависимости от их положения в периодической системе охарактеризован ранее (см. 3.4). Слева направо по периоду основные свойства оксидов ослабевают, а кислотные — усиливаются.
В группах А с ростом атомного номера элемента наблюдается усиление основных свойств оксидов и ослабление — кислотных.
Если один и тот же элемент образует несколько оксидов с различной степенью окисления атома, то чем выше степень окисления атома, тем сильнее у оксида выражены кислотные свойства.
Например, оксиду SO2 отвечает слабая кислота H2SO3, а оксиду SO3 — сильная серная кислота H2SO4; оксид хрома(II) CrO — основный, оксид хрома(III) Cr2O3 — амфотерный (т.е. основные свойства ослабились, появились кислотные), а оксид хрома(VI) CrO3 — кислотный оксид, который основных свойств не проявляет.
Химические свойства осно́вных оксидов.
1. Основные оксиды реагируют с водой. В эту реакцию вступают только оксиды щелочных и щелочноземельных металлов. Продуктом реакции являются основания (щелочи):
Na2O + H2O = 2NaOH
K2O + H2O = 2KOH
BaO + H2O = Ba(OH)2
CuO + H2O
2. Основные оксиды взаимодействуют с кислотными оксидами с образованием солей соответствующих кислот (формула кислоты дана в скобках):
K2O + CO2 = K2CO3 — соль угольной кислоты (H2CO3), карбонат калия;
Na2O + N2O5 = 2NaNO3 — соль азотной кислоты (HNO3), нитрат натрия;
3BaO + P2O5 = Ba3(PO4)2 — соль фосфорной кислоты (H3PO4), фосфат бария;
CaO + SO2 = CaSO3 — соль сернистой кислоты (H2SO3), сульфит кальция;
K2O + SO3 = K2SO4 — соль серной кислоты (H2SO4), сульфат калия;
Rb2O + SiO2

3. Основные оксиды взаимодействуют с кислотами по типу реакции обмена. Продуктами этой реакции являются соль соответствующей кислоты и вода:
Na2O + 2HCl = 2NaCl + H2O
3K2O + 2H3PO4 = 2K3PO4 + 3H2O
BaO + 2HNO3 = Ba(NO3)2 + H2O
Химические свойства кислотных оксидов.
1. Кислотные оксиды взаимодействуют с водой (не реагирует с водой SiO2), образуются кислоты:
CO2 + H2O ⇄ H2CO3 — угольная кислота;
SO3 + H2O = H2SO4 — серная кислота;
SO2 + H2O ⇄ H2SO3 — сернистая кислота;
P2O5 + 3H2O = 2H3PO4 — ортофосфорная кислота;
N2O3 + H2O = 2HNO2 — азотистая кислота;
N2O5 + H2O = 2HNO3 — азотная кислота;
Mn2O7 + H2O = 2HMnO4 — марганцевая кислота;
CrO3 + H2O = H2CrO4 — хромовая кислота;
2CrO3 + H2O = H2Cr2O7 — дихромовая кислота;
2NO2 + H2O = HNO2 + HNO3 — образуется смесь азотной и азотистой кислот.
2. Кислотные оксиды реагируют с основными оксидами, образуются соли соответствующих кислот (см. выше):
SO2 + K2O = K2SO3
P2O5 + 3Na2O = 2Na3PO4
3. Кислотные оксиды реагируют с основаниями, образуются соль и вода. Особенно хорошо вступают в эту реакцию сильные основания — щелочи:
SO2 + 2KOH = K2SO3 + H2O
SO3 + 2NaOH = Na2SO4 + H2O
P2O5 + 3Ba(OH)2 = Ba3(PO4)2↓ + 3H2O
N2O5 + 2KOH = 2KNO3 + H2O
SiO2 + 2KOH = K2SiO3 + H2O
Химические свойства амфотерных оксидов.
1. С водой амфотерные оксиды не взаимодействуют (в воде не растворяются).
2. Амфотерные оксиды реагируют при нагревании с основными оксидами с образованием средних солей, проявляя при этом свойства кислотных оксидов:
Al2O3 + K2O 
ZnO + Na2O 
BeO + BaO 
3. Амфотерные оксиды реагируют с кислотными оксидами с образованием средних солей, проявляя при этом свойства основных оксидов:
Al2O3 + 3SO3

3ZnO + P2O5 = Zn3(PO4)2 — фосфат цинка.
4. Амфотерные оксиды реагируют с кислотами с образованием средних солей и воды, проявляя при этом свойства основных оксидов:
Fe2O3 + 6HCl = 2FeCl3 + 3H2O
Al2O3 + 3H2SO4 = Al2(SO4)3 + 3H2O
ZnO + 2HNO3 = Zn(NO3)2 + H2O
5. Амфотерные оксиды при сплавлении (реакция протекает с твердой щелочью и при нагревании) и в водных растворах реагируют со щелочами. В обоих случаях образуются соли, но их состав совершенно различен: при сплавлении образуются средние (нормальные) соли, а в водном растворе — комплексные соли, содержащие ОН-группу:
Al2O3 + 2KOH (тв) 
ZnO + 2NaOH (тв) 
BeO + 2KOH (тв) 
Al2O3 + 6KOH + 3H2O = 2K3[Al(OH)3] — гексагидроксоалюминат калия;
ZnO + 2NaOH + H2O = Na2[Zn(OH)4] — тетрагидроксоцинкат натрия;
BeO + 2KOH + H2O = K2[Be(OH)4] — тетрагидроксобериллат калия.
6. Амфотерные оксиды при нагревании с вытеснением CO2 и образованием средних солей реагируют с твердыми карбонатами:
Al2O3 + CaCO3

Al2O3 + Na2CO3

Пример 6.1. Укажите формулы веществ, взаимодействуя с которыми оксид алюминия проявляет кислотные свойства:
а) SO3; б) NaOH; в) CaO; г) HNO3.
Решение. Оксид алюминия — амфотерный оксид, кислотные свойства проявляет в реакциях со щелочами:
Al2O3 + 2KOH (тв) 
Al2O3 + 6KOH + 3H2O = 2K3[Al(OH)6]
и основными оксидами:
Al2O3 + CaO 
Ответ: б), в).
Специфические свойства оксидов. Эти свойства во многом связаны с их способностью участвовать в окислительно-восстановительных реакциях:
Fe2O3 + 3H2

Oксид углерода(II) обладает выраженными восстановительными свойствами и восстанавливает металлы из их оксидов:
CuO + CO 
Оксид кремния(IV) при нагревании вытесняет из карбонатов более летучий оксид углерода(IV):
SiO2 + CaCO3

Другие специфические свойства оксидов будут рассмотрены при изучении химии элементов и их соединений.
Cпособы получения оксидов весьма разнообразны (табл. 6.1).
| Тип реакции | Примеры |
|---|---|
| Окисление простых веществ (галогены, Au и Pt не реагируют с О2) | 2Ca + O2 = 2CaO C + O2 = CO2 4Al + 3O2 = 2Al2O3 |
| Термическое разложение некоторых кислот, оснований и солей | H2SiO3
 SiO2 + H2O SiO2 + H2OCu(OH)2  CuO + H2O CuO + H2OCaCO3  CaO + CO2↑ CaO + CO2↑ |
| Окисление сложных веществ кислородом | 4FeS2 + 11O2 = 2Fe2O3 + 8SO2↑ |
| Взаимодействие металлов и неметаллов с кислотами-окислителями | Cu + 2H2SO4 = CuSO4 + SO2↑ + 2H2O C + 2H2SO4 = CO2↑ + 2SO2↑ + 2H2O |
| Окисление низших оксидов в высшие или восстановление высших оксидов | 2CO + O2
 2CO2 2CO2
Fe2O3 + C  2FeO + CO 2FeO + CO |
| Взаимодействие солей и кислот | CaCO3 + 2HCl = CaCl2 + H2O + CO2↑ 2KHSO3 + H2SO4  K2SO4 + 2SO2↑ + 2H2O K2SO4 + 2SO2↑ + 2H2O |
Пример 6.2. Солеобразующий оксид (оксиды) образуется (-ются) в результате:
а) растворения Cu в HNO3 (конц);
б) восстановления СО2 коксом;
в) обжига известняка;
г) взаимодействия питьевой воды с соляной кислотой.
Решение. Записываем уравнения реакций, в которых подчеркиваем формулы солеобразующих оксидов:
а) Cu + 4HNO3 (конц) = Cu(NO3)2 + 2NO2↑ + 2H2O;
б) CO2 + C 
в) CaCO3

г) NaHCO3 + HCl = NaCl + CO2↑ + H2O.
Ответ: а), в), г).










