Химия
Валентность — мера способности атомов данного элемента соединяться между собой или с атомами других элементов.
Ковалентность — число ковалентных связей, посредством которых данный атом связан с другими атомами. Таким образом, ковалентность — численная характеристика валентности.
Ковалентная связь образуется либо одноэлектронными АО (обменный механизм), либо электронными парами и вакантными АО (донорно-акцепторный механизм), поэтому ковалентность атома равна числу атомных орбиталей, которые он использует для образования ковалентных связей (эти АО называются валентными). Число валентных АО не всегда равно числу валентных (участвующих в образовании химической связи) электронов. Например, в атоме азота число валентных АО равно 4 (одна 2s и три 2p), а число валентных электронов равно 5 (2s 22p 3). Напомним, что для элементов А-групп валентными являются только s- и p- электроны внешнего электронного слоя, а для элементов В-групп — s-электроны внешнего и d-электроны предвнешнего электронных слоев (в случае d-элементов).
Ковалентность целочисленна и не имеет знака, ее указывают римской цифрой.
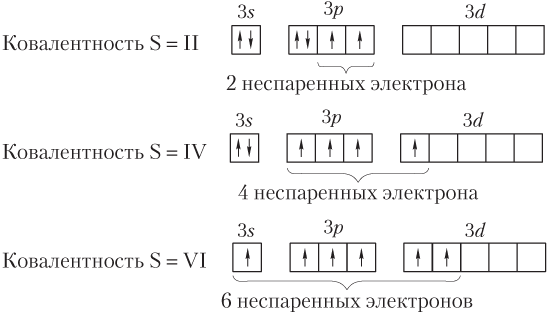
С учетом того, что ковалентные связи могут образовываться по обменному или донорно-акцепторному механизму, можно утверждать, что ковалентность атомов зависит от числа неспаренных электронов и неподеленных пар, а также вакантных орбиталей на валентных энергетических уровнях и подуровнях. Поэтому становится понятным, что высшая ковалентность всех атомов элементов 2-го периода равна четырем, т.е. указанные атомы максимально могут образовать только 4 ковалентные связи. Например, ковалентность атома бора становится такой, когда он, находясь в возбужденном состоянии, образует три ковалентные связи по обменному механизму и одну — по донорно-акцепторному:

Высшая ковалентность атома азота также равна четырем (на валентном — втором энергетическом уровне — имеются четыре АО: одна s и три р), которая достигается образованием трех связей по обменному механизму и одной — по донорно-акцепторному:

Объясняют такую высшую ковалентность атомов элементов 2-го периода исходя из того, что в этом случае вакантные орбитали более высоколежащих энергетических уровней недоступны для вовлечения в химическую связь (имеют слишком высокую энергию). Однако в атомах элементов 3-го периода имеются 3d-орбитали, энергия которых не сильно отличается от энергии 3s- и 3p-орбиталей. Поэтому валентные возможности атомов элементов этого периода увеличиваются за счет распаривания спаренных электронов внешнего слоя и перехода их на вакантные 3d-AO, как, например, у атома серы:
Понятие «валентность» применимо только к соединениям с ковалентной связью. Нельзя, например, сказать, что в хлориде натрия (ионное соединение) ковалентность атомов натрия и хлора равна I. Поскольку большинство неорганических веществ имеют ионное строение, для них более универсальной характеристикой состояния атома в химическом веществе является степень окисления.
Степень окисления — это условный заряд атома в химическом соединении, определяемый в предположении, что все связи в нем, кроме ковалентных неполярных, ионные.
В отличие от ковалентности, степень окисления имеет знак, может быть как целочисленной, так и дробной или равной нулю. Обозначают степень окисления арабской или римской цифрой, перед которой ставят соответствующий знак, например: +1, −3, 0. Степень окисления указывают над символом элемента. В бинарном соединении (NaCl, K2S, CaH2) отрицательную степень окисления имеет атом с большей электроотрицательностью.
Правила расчета степени окисления:
1. В простых веществах степень окисления атомов равна нулю (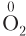
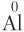
2. Степень окисления атома в одноатомном ионе равна заряду иона: например, степень окисления атома кальция в ионе Ca2+ равна +2.
3. Металлы в соединениях имеют только положительную степень окисления: для атомов щелочных металлов она всегда равна +1, для атомов элементов групп IIА и IIВ — +2, для атома алюминия в устойчивых соединениях — +3.
4. Во всех сложных соединениях степень окисления атома фтора, как наиболее электроотрицательного элемента, равна −1.
5. Кислород — второй по электроотрицательности элемент, поэтому в сложных соединениях степень окисления атома кислорода равна −2. Исключения: соединения со фтором (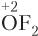
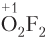
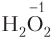

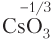
6. Степень окисления атома водорода в большинстве соединений равна +1, за исключением гидридов металлов (

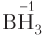
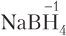

7. В электронейтральных частицах алгебраическая сумма степеней окисления всех атомов равна нулю, а в сложных ионах — заряду иона.
8. Высшая положительная степень окисления атома, как правило, равна номеру группы в периодической системе (исключения: медь, серебро, золото, фтор, кислород), например, высшая степень окисления атома азота равна +5 (не путайте с валентностью!).
9. Для атомов неметаллов групп IVA–VIIA низшая отрицательная степень окисления равна разности номера группы и числа 8; например, для атомов азота и хлора низшие значения степени окисления соответственно равны −3 (5 − 8 = −3) и −1 (7 − 8 = −1). Низшая степень окисления атома бора равна −3. Для атомов металлов низшая степень окисления равна нулю.
Низшую степень окисления неметаллы проявляют в соединениях с металлами (


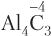
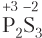
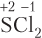
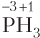
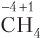
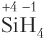
Рассмотрим примеры расчета степени окисления атомов для электронейтральных и заряженных частиц.
Определим степень окисления атома Mn в K2MnO4. Согласно правилам 3 и 4 степень окисления атома калия +1 и −2 у атома кислорода, поэтому в соответствии с правилом 7 имеем (х — степень окисления атома марганца):
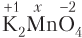
2(+1) + x + 4(−2) = 0;
х = + 6.
Определим степень окисления атома Сr в ионе . Согласно правилу 5, степень окисления атома кислорода равна +2, поэтому с учетом заряда иона, равного −2, и числа атомов хрома (2) имеем (х — степень окисления хрома):
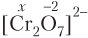
2x + 7(−2) = −2;
x = + 6.
Определим степень окисления атома железа в составе Fe2(SO4)3. Заряд группировки атомов SO4 равен −2. Тогда имеем:
; x = +3.
Определим степень окисления атома хрома в составе комплексной соли [Cr(NH3)3(H2O)3]Cl3. Молекулы NH3 и H2O электронейтральны, а заряд хлорид-иона равен −1. Имеем:
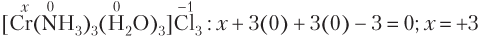
Для одного и того же атома в одном и том же соединении или ионе численные значения степени окисления и ковалентности могут как совпадать (NH3, CH4, H2O), так и не совпадать (H2O2, , HNO3). Несовпадение наблюдается для простых веществ молекулярного строения (N2, H2, O2), в случае которых степень окисления атомов всегда равна нулю, а также если:
- атом участвует в образовании мостиковых связей; в этом случае численное (по модулю) значение степени окисления атома всегда меньше его ковалентности:
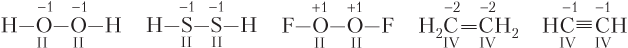
- атом участвует в образовании связей по донорно-акцепторному механизму; при этом численное (по модулю) значение степени окисления атома может быть как больше, так и меньше его валентности, что зависит от электроотрицательности атома донора и атома акцептора:
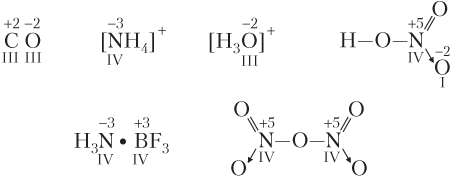
- атом образует ковалентные связи одновременно как с более, так и с менее электроотрицательными атомами:

Рассмотрим несколько примеров решения других заданий по расчету ковалентности и степени окисления атомов.
Пример 5.5. Степень окисления атома серы равна −1 в составе: а) SCl2; б) FeS2; в) ; г) P2S3.
1) а, б;
2) б, в;
3) в, г;
4) а, г.
Решение.
а) 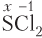
б) 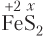
в) 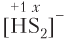
г) 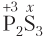
Ответ: 2).
Пример 5.6. Определите ковалентность и степень окисления атома азота в ионе аммония.
Решение. В ионе аммония атом азота образует 4 одинарные связи с атомами водорода (см. табл. 4.1), поэтому ковалентность атома азота равна IV. Определяем степень окисления атома азота:
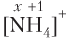
Ответ: ковалентность азота равна IV, степень окисления −3.
Пример 5.7. Определите ковалентность и степень окисления атома азота в молекуле азотной кислоты.
Решение. В молекуле азотной кислоты
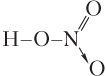
атом азота образует 4 связи с атомами кислорода, поэтому ковалентность атома азота равна IV. В соответствии с правилами расчета степени окисления запишем:

Тогда
+1+ x + 3(−2) = 0;
х = +5.
Ответ: ковалентность атома азота равна IV, степень окисления +5.
Пример 5.8. Атомы с ковалентностью равной III имеются в составе: а) CO; б) H2O2; в) H3O+ г) N2H4.
1) а, в, г;
2) б, в, г;
3) а, б, в;
4) а, б, г.
Решение. Записываем структурные формулы частиц:
а) 
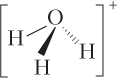

Видим, что трехковалентные атомы есть в составе молекул СО (трехковалентные атомы С и О), N2H4 (трехковалентный атом N) и иона H2O+ (трехковалентный атом О).
Ответ: 1).
Обратите внимание, что во всех вышерассмотренных частицах численные значения ковалентности и степени окисления атомов С, О и N в составе одного и того же вещества не совпадают.
Пример 5.9. Алгебраическая сумма высшей ковалентности и низшей степени окисления равна 1 для атома:
1) O;
2) Cl;
3) N;
4) C.
Решение. Атом О: высшая ковалентность равна IV, низшая степень окисления составляет −2; алгебраическая сумма равна 2.
Атом Cl: высшая ковалентность равна VII, низшая степень окисления составляет −1, алгебраическая сумма равна 6.
Атом N: высшая ковалентность равна IV, низшая степень окисления составляет −3; алгебраическая сумма равна 1.
Атом C: высшая ковалентность равна IV, низшая степень окисления составляет −4, алгебраическая сумма равна нулю.
Ответ: 3).
Пример 5.10. Рассчитайте степень окисления всех атомов углерода в молекуле ацетальдегида.
Решение. Находить степень окисления атомов углерода в молекулах органических веществ удобно по графической формуле молекулы.
Записываем графическую формулу ацетальдегида
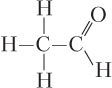
Степень окисления каждого из атомов углерода находится алгебраическим суммированием степеней окисления по всем образуемым им связям с учетом электроотрицательности атомов. Поскольку χ(C) > χ(H), но χ(C) < χ(O, N, галогенов), то каждая связь C–H приводит к появлению на атоме С одного единичного отрицательного заряда, а каждая связь C–О (N, галоген) — одного единичного положительного заряда. С учетом этого имеем (ковалентная неполярная связь С–С не дает вклад в степень окисления):
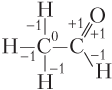
Таким образом, степень окисления левого атома С равна −1 + + (−1) + (−1) = −3, а правого — + 1 + 1 − 1 = +1.
Ответ: −3, +1.
Не всегда ковалентная связь является двухэлектронной и двухцентровой. Строение ряда молекул можно объяснить только с учетом образования делокализованных (многоцентровых) связей, которые обозначаются пунктирными линиями [5]. Примеры таких молекул — HNO3 и C6H6 (бензол):
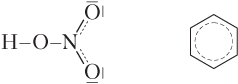
В первом случае образуется четырехэлектронная трехцентровая связь, а во втором — шестиэлектронная шестицентровая (см. 25.1). Отметим, что в случае таких молекул классический расчет ковалентности как числа двухэлектронных двухцентровых связей для атомов, участвующих в образовании делокализованных связей, теряет смысл.










