Химия
Основания (основные гидроксиды) — это электролиты, при диссоциации которых в водных растворах в качестве анионов образуются только гидроксид-ионы ОН−.
Неорганические основания состоят из иона металла и одной или нескольких гидроксогрупп. Основными свойствами обладают также аммиак и его водные растворы, а также некоторые органические соединения, например амины и аминокислоты.
Другие определения оснований:
- основания — это гидроксиды (т.е. гидраты — продукты взаимодействия оксида и воды) с основными свойствами;
- основания — это сложные вещества, состоящие из ионов металла и одной или нескольких гидроксогрупп.
По международной номенклатуре основания называются гидроксидами; при этом, если нужно, указывают степень окисления атома металла: Cu(OH)2 — гидроксид меди(II), но КОН — гидроксид калия.
Некоторые основания имеют тривиальные названия: Ca(OH)2 — гашеная известь, а водный раствор этого основания — известковая вода (известковое молоко — суспензия Ca(OH)2), баритовая вода — водный раствор Ba(OH)2, NaOH — едкий натр, KOH – едкое кали.
Основания, образованные элементами металлами, имеют немолекулярное строение, при обычных условиях они твердые. Гидроксиды s-металлов бесцветные, гидроксиды многих d-металлов окрашены, например: Cr(OH)3 — серовато-зеленый, Fe(OH)3 — бурый, Cu(OH)2 — синий.
Основания классифицируют по кислотности и силе. Однокислотные основания содержат одну группу ОН, двухкислотные — две группы ОН и т.д.
К сильным относятся основания, которые в водных растворах полностью диссоциируют с образованием гидроксид-ионов; к ним относятся хорошо или сравнительно хорошо растворимые в воде гидроксиды щелочных металлов, бария и стронция, а также малорастворимый гидроксид кальция. Перечисленные основания называются также щелочами.
Слабыми нерастворимыми в воде основаниями являются Mg(OH)2, Cu(OH)2, Fe(OH)2, Cr(OH)2 и др., к числу слабых оснований относится гидрат аммиака NH3 ⋅ H2O.
К амфотерным относятся гидроксиды, которые проявляют химические свойства как оснований, так и кислот: Al(OH)3, Zn(OH)2, Be(OH)2, Cr(OH)3, Fe(OH)3, Mn(OH)4, Pb(OH)2, Sn(OH)2.
Основные свойства оснований зависят от положения элемента в периодической системе.
Напомним, что слева направо по периоду основные свойства гидроксидов ослабевают.
В группах А сверху вниз происходит усиление основных свойств.
В случае, когда металл образует несколько оснований (гидроксидов), основные свойства более выражены у того из них, в составе которого степень окисления атома металла меньше: так, Fe(OH)2 обладает более сильными основными свойствами, чем Fe(OH)3, а Mn(OH)4 — гидроксид с более слабыми основными свойствами, чем Mn(OH)2.
Химические свойства нерастворимых оснований.
1. В водных растворах эти основания диссоциируют обратимо и в незначительной степени:
Cu(OH)2 ⇄ CuOH+ + OH−;
CuOH+ ⇄ Cu2+ + OH−.
Водные растворы этих оснований ввиду малой концентрации гидроксид-ионов окраску индикаторов не изменяют.
2. Все нерастворимые основания легко разлагаются при нагревании с образованием воды и соответствующего оксида металла:
Cu(OH)2

Mg(OH)2

3. Все нерастворимые основания реагируют с кислотами (реакция нейтрализации) с образованием воды и соли:
Cu(OH)2 + H2SO4 = CuSO4 + 2H2O
Mg(OH)2 + 2HNO3 = Mg(NO3)2 + 2H2O
Cu(OH)2 + 2CH3COOH = (CH3COO)2Cu + 2H2O
3Mg(OH)2 + 2H3PO4

Химические свойства щелочей.
1. В водных растворах щелочи полностью диссоциируют:
NaOH → Na+ + OH−
Ba(OH)2 → Ba2+ + 2OH−
Благодаря высокой концентрации гидроксид-ионов водные растворы щелочей изменяют окраску индикаторов: лакмус фиолетовый приобретает синюю окраску, метилоранж — желтую, фенолфталеин — малиновую.
2. Щелочи разъедают растительные и животные ткани.
3. Щелочи реагируют со всеми кислотными оксидами, в водном растворе и при сплавлении — с амфотерными оксидами (см. 6.1.2).
4. Щелочи реагируют со всеми кислотами (реакция нейтрализации), образуются соль и вода:
2NaOH + H2CO3 = Na2CO3 + 2H2O
3KOH + H3PO4 = K3PO4 + 3H2O
Ba(OH)2 + 2HNO3 = Ba(NO3)2 + 2H2O
5. Щелочи в водном растворе или при сплавлении реагируют с амфотерными гидроксидами с образованием соответственно комплексных или средних солей:
2NaOH (p-p) + Zn(OH)2 = Na2[Zn(OH)4]
3KOH (p-p) + Al(OH)3 = K3[Al(OH)6]
2NaOH (тв) + Zn(OH)2

KOH (тв) + Al(OH)3

6. Щелочи вступают в реакцию обмена с солями. Реакция протекает при выполнении двух условий:
а) исходная соль должна быть растворима в воде;
б) в результате реакции должен образоваться газ, осадок или слабый электролит.
Приведем примеры таких реакций:
2KOH + MgCl2 = Mg(OH)2↓ + 2KCl
NaOH + NH4NO3

Ba(OH)2 + Na2SO4 = BaSO4↓ + 2NaOH
Не реагируют со щелочами, например, CuS и CaCO3 (эти соли нерастворимы в воде), KNO3 и NaCl (в результате реакции не образуется осадок).
Со щелочами взаимодействуют все соли аммония, так как продуктом реакции всегда является слабое основание (NH3 ⋅ H2O) или (при нагревании) газ (NH3) и слабый электролит (H2O):
NH4Cl + KOH = KCl + NH3 ⋅ H2O
7. Щелочи реагируют с некоторыми неметаллами (галогены, Si, S, P):
2KOH + Cl2

6KOH + 3Cl2

2NaOH + Si + H2O = Na2SiO3 + 2H2↑
6KOH + 3S = 2K2S + K2SO3 + 3H2O
и некоторыми металлами (Al, Zn, Be):
2Al + 6KOH + 6H2O = 2K3[Al(OH)6] + 3H2↑
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2↑
8. Щелочи реагируют с органическими веществами:
- фенолом:
C6H5OH + KOH → C6H5OK + H2O
- сложными эфирами, жирами:

9. При нагревании некоторые щелочи разлагаются с образованием воды и оксида металла:
2LiOH 
Ca(OH)2

Плавятся без разложения (т.е. не разлагаются до плавления) NaOH и KOH
Пример 6.3. Укажите формулы солей, взаимодействующих с KOH в водном растворе:
а) CuS; б) MgSO4; в) NaNO3; г) CuCl2.
Решение. C KOH не реагируют CuS (сульфид меди(II) нерастворим в воде) и NaNO3 (в результате реакции не образуется осадок). Реагируют MgSO4 и CuCl2:
MgSO4 + 2KOH = Mg(OH)2↓ + K2SO4
CuCl2 + 2KOH = Cu(OH)2↓ + 2KCl
Ответ: б), г).
Химические свойства гидрата аммиака. Гидрат аммиака реагирует:
- с кислотными оксидами:
2NH3 ⋅ H2O + SO2 = (NH4)2SO3 + H2O
- растворимыми солями (если выпадает осадок):
3NH3 ⋅ H2O + AlCl3 = Al(OH)3↓ + 3NH4Cl
- кислотами (реакция нейтрализации):
NH3 ⋅ H2O + HCl = NH4Cl + H2O
Водный раствор аммиака, подобно щелочам, меняет окраску индикаторов.
Как уже отмечалось, амфотерные гидроксиды проявляют химические свойства и кислот, и оснований.
1. Амфотерные гидроксиды в воде нерастворимы, поэтому концентрация гидроксид-ионов в их водных растворах очень мала. Вследствие этого водные растворы амфотерных гидроксидов окраску индикаторов не изменяют. Подобно слабым основаниям диссоциируют обратимо и в незначительной степени.
2. Подобно всем нерастворимым в воде гидроксидам амфотерные гидроксиды разлагаются при нагревании с образованием амфотерного оксида и воды:
2Al(OH)3

Zn(OH)2

3. Амфотерные гидроксиды реагируют при сплавлении или в водных растворах со щелочами, проявляя при этом кислотные свойства (см. 6.2.2).
4. Амфотерные гидроксиды реагируют с кислотами, проявляя при этом основные свойства:
Al(OH)3 + 3HNO3 = Al(NO3)3 + 3H2O
Zn(OH)2 + H2SO4 = ZnSO4 + 3H2O
Cr(OH)3 + H3PO4 = CrPO4↓ + 3H2O
5. Амфотерные гидроксиды при нагревании реагируют с основными оксидами, проявляя при этом свойства кислот:
2Al(OH)3 + K2O 
Zn(OH)2 + BaO 
6. Амфотерные гидроксиды реагируют с кислотными оксидами (проявление основных свойств):
2Al(OH)3 + 3SO3

3Zn(OH)2 + P2O5

7. Амфотерные гидроксиды реагируют при сплавлении с карбонатами:
2Al(OH)3 + CaCO3

Пример 6.4. Гидроксид цинка может взаимодействовать с каждым из веществ, формулы которых:
1) Na2CO3, CuCl2; 3) HCl, Al;2) KOH, H2SO4; 4) Na2O, BaCl2.Решение. Гидроксид цинка — амфотерный гидроксид. Из указанных веществ он реагирует с Na2CO3 (при нагревании), кислотами HCl, H2SO4, щелочью KOH и основным оксидом Na2O.
Ответ: 2).
Рассмотрим способы получения нерастворимых в воде оснований, амфотерных гидроксидов и гидрата аммиака.
Нерастворимые в воде основания и амфотерные гидроксиды получают взаимодействием соответствующих растворимых солей и щелочей. В случае амфотерных гироксидов во избежание их растворения в избытке щелочи лучше использовать гидрат аммиака:
MgSO4 + 2KOH = Mg(OH)2↓ + K2SO4
CrCl3 + 3NH3 ⋅ H2O = Cr(OH)3↓ + 3NH4Cl
Пример 6.5. Для получения гидроксида магния в реакции с водным раствором KOH наиболее целесообразно взять соль:
1) Mg(NO3)2; 3) Mg3(PO4)2;2) MgCO3; 4) MgSiO3.Решение. Искомая соль должна растворяться в воде. Следовательно, это Mg(NO3)2.
Ответ: 1).
Гидрат аммиака получают растворением аммиака в воде:
NH3 + H2O = NH3 ⋅ H2O
или по реакции обмена:
(NH4)2SO4 + Ba(OH)2
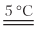
Пример 6.6. Гидроксид алюминия образуется при взаимодействии:
а) AlCl3 и KOH (р-р, изб);
б) Al2(SO4)3 и NH3 ⋅ H2O (изб);
в) Al2O3 и H2O;
г) 1 моль Al2SO4 и 6 моль KOH (р-р).
Решение. С водой не реагирует Al2O3. В растворе при взаимодействии AlCl3 с избытком KOH образуется комплексная соль:
AlCl3 Al(OH)3 K3[Al(OH)6]
Al(OH)3 образуется в случаях: б), так как Al(OH)3 в избытке NH3 ⋅ H2O не растворяется:
Al2(SO4)3 + 6NH3 ⋅ H2O = 2Al(OH)3↓ + 3(NH4)2SO4
и г):
Al2(SO4)3 + 6KOH = 2Al(OH)3↓ + 3K2SO4.
Ответ: б), г).
Способы получения щелочей представлены в табл. 6.2.
| Тип реакции | Примеры |
|---|---|
| Взаимодействие щелочного или щелочноземельного металла с водой | 2K + 2H2O = 2KOH + H2↑ Ba + 2H2O = Ba(OH)2 + H2↑ |
| Взаимодействие соответствующего основного оксида с водой | Na2O + H2O = 2NaOH CaO + H2O = Ca(OH)2 |
| Взаимодействие гидридов щелочных и щелочноземельных металлов с водой | KH + H2O = KOH + H2↑ CaH2 + 2H2O = Ca(OH)2 + 2H2↑ |
| По реакции обмена растворимая соль + щелочь (если выпадает осадок) | K2CO3 + Ba(OH)2 = 2KOH + BaCO3↓ Na2SO4 + Ca(OH)2 = 2NaOH + CaSO4↓ |
Электролиз ( ) водных растворов галогенидов щелочных и щелочноземельных металлов ) водных растворов галогенидов щелочных и щелочноземельных металлов | 2KCl + 2H2O  2KOH + H2↑ + Cl2↑ 2KOH + H2↑ + Cl2↑BaCl2 + 2H2O  Ba(OH)2 + H2↑ + Cl2↑ Ba(OH)2 + H2↑ + Cl2↑ |










