Химия
Несмотря на свою электронейтральность, молекулы способны взаимодействовать между собой. Это взаимодействие называют межмолекулярным или ван- дер- ваальсовым (в честь голландского физика И.Д. Ван-дер-Ваальса). Именно благодаря действию этих сил вещества при понижении температуры переходят из газообразного в жидкое, а затем в твердое состояние. Силы межмолекулярного взаимодействия, как и химическая связь, имеют электростатическую природу (т.е. обусловлены притяжением разноименных зарядов), однако они не связаны с перекрыванием атомных орбиталей и перераспределением электронной плотности. Энергия межмолекулярного взаимодействия возрастает с ростом абсолютной величины притягивающихся зарядов.
Различают три составляющие межмолекулярного взаимодействия:
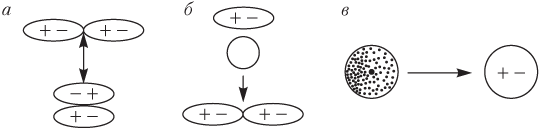
а) взаимодействие между полярными молекулами (диполями). Это взаимодействие называют ориентационным или диполь-дипольным (рис. 5.2, а);
б) индукционное взаимодействие, которое реализуется между полярной и неполярной молекулами вследствие того, что в неполярной молекуле под действием электрического поля полярной молекулы также возникает (индуцируется) диполь (рис. 5.2, б);
в) дисперсионное взаимодействие; это взаимодействие так называемых мгновенных диполей (рис. 5.2, в), которые возникают в неполярных молекулах вследствие флуктуации (колебаний) электронной плотности (в какой-то момент времени в одной области атома или молекулы электронная плотность увеличивается, что приводит к появлению мгновенных диполей не только в данной, но и в соседних молекулах). Такое взаимодействие имеет место и между полярными молекулами, но в случае неполярных молекул — это единственный вид межмолекулярного взаимодействия.
Часто утверждают, что из всех видов немолекулярного взаимодействия дисперсионное самое слабое. Это неверно, например, в случае хлороводорода HCl, молекула которого полярна (!), на долю дисперсионного взаимодействия приходится около 80 % от общей энергии ван-дер-ваальсовых взамодействий.
Энергия межмолекулярного взаимодействия на порядок меньше энергии химических связей, однако оно сильно влияет на температуры плавления и кипения веществ, их теплопроводность, электрическую проводимость, летучесть и т.д.
Чем больше энергия межмолекулярного взаимодействия, тем выше t пл и t кип, а летучесть — меньше.
Энергия межмолекулярного взаимодействия зависит от степени полярности молекулы и числа электронов в ней, от поляризуемости (т.е. способности электронного облака молекулы к деформации, изменению), температуры, давления, расстояния между молекулами и их формы.
Энергия межмолекулярного взаимодействия возрастает:
- с понижением температуры;
- увеличением давления (для газов);
- ростом полярности молекул (например, для этанола С2Н5ОН она выше, чем для диметилового эфира (СН3)2О);
- ростом массы молекул вещества (например, для Br2 она выше, чем для Cl2), поскольку при этом возрастают число электронов в ней и способность электронного облака к поляризуемости.
Поскольку масса молекулы пропорциональна молярной массе, можно считать, что энергия межмолекулярного взаимодействия тем больше, чем больше молярная масса вещества (забегая вперед отметим, что это справедливо только при отсутствии водородных связей).
Энергия межмолекулярного взаимодействия зависит еще и от геометрии молекулы, поскольку она влияет на площадь соприкосновения молекул. Например, при одной и той же молярной массе алканы с неразветвленной цепью атомов углерода в молекуле имеют более высокую температуру кипения, чем алканы разветвленного строения. Это обусловлено тем, что в случае неразветвленных молекул площадь их соприкосновения больше и соответственно большее число электронов участвует в образовании мгновенных диполей. Кроме того, разветвление препятствует более тесному сближению молекул.
Энергия межмолекулярного взаимодействия возрастает с уменьшением расстояния между молекулами. При понижении температуры или при увеличении давления расстояние между молекулами уменьшается, межмолекулярное взаимодействие возрастает и вещество последовательно переходит из газообразного состояния в жидкое, а затем — в твердое.










