Химия
Ионная связь — это химическая связь, осуществляемая электростатическим притяжениям разноименно заряженных ионов, т.е. катиона и иона.
В бинарных соединениях ионная связь возникает между типичными металлами и типичными неметаллами, поскольку первые легко отдают валентные электроны, а вторые охотно их принимают, как это показано для СаF2:
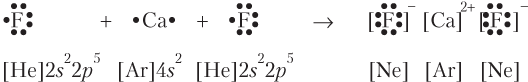
В результате каждый ион приобретает устойчивую электронную оболочку соответствующего благородного газа. Ионная связь образуется в бинарных соединениях металлов: в основных и амфотерных оксидах (Na2O, Al2O3), гидридах (NaH), галогенидах (KF), халькогенидах (K2S, Na2Se), нитридах (Ca3N2), фосфидах (Mg3P2), силицидах (Ca2Si) и карбидах (Al4C3) металлов.
Ионная связь образуется в многоэлементных соединениях: солях (NH4Cl, KNO3, Na3PO4), основаниях (KOH, Ba(OH)2, Ca(OH)2). При этом в солях, образованных сложными катионами или сложными анионами, сочетаются два вида связи: ионная и ковалентная полярная. Например, в нитрате аммония связь между катионом и аниономионная, а в сложных ионах и — ковалентная полярная. В основаниях связь между катионом металла и гидроксогруппой ионная, а между атомами в гидроксогруппе — ковалентная полярная. В соединениях FeS2, CaC2, BaO2 (и других пероксидах металлов — K2O2, CaO2 и т.п.) одновременно присутствует ионная и ковалентная неполярная связи: [Fe]2+[S−1–S−1]2−, [Ca]2+[C−1≡C−1]2−, [Ba]2+[O−1–O−1]2−. Дисульфиды являются производными дисульфида водорода H–S–S–H (аналог H2O2), карбиды — ацетилена (H–C≡C–H), а пероксиды — производными пероксида водорода (H–O–O–H).
Следует иметь в виду, что в действительности связи на 100 % ионными никогда не бывают. Поэтому говорят о степени ионности связи, которую качественно оценивают по разности электроотрицательностей атомов; например, степень ионности KF больше, чем в KI, так как χ(F) > χ(I). Считается, что связь между атомами ионная, если для них ∆χ ≥ 2.
Подобно ковалентной связи ионная связь характеризуется длиной (0,16–0,3 нм) и энергией (порядка нескольких килоджоуль на моль), но, в отличие от ковалентной, ионная связь ненаправленная и ненасыщаемая.
Ненаправленность ионной связи объясняется тем, что силы электростатического взаимодействия (линии вектора напряженности ) не ориентированы, т.е. направлены во все стороны, поэтому каждый ион притягивает ионы противоположного заряда в любом направлении:

Ненасыщаемость ионной связи следует из того, что каждый заряд может притягивать любое число противоположных зарядов (очевидно, что с увеличением расстояния между зарядами сила притяжения между ними ослабевает).
Атомы металлов обладают двумя особенностями, которые отсутствуют у атомов неметаллов:
- имеют низкие значения энергий ионизации, благодаря чему легко отдают свои валентные электроны не только при взаимодействии металлов с неметаллами, но и при образовании металлических кристаллов из одних и тех же или разных атомов;
- на валентных подуровнях содержат большое число валентных орбиталей, например, валентный электрон атома натрия может располагаться на девяти АО: 3s (одна), 3p (три) и 3d (пять)
При образовании металлического кристалла валентные АО соседних атомов перекрываются и образуется общая система очень близко расположенных общих орбиталей. Валентные электроны при этом покидают свои атомы, образуются катионы металлов
Me − ne − = Me n +,
а валентные электроны свободно (подобно молекулам в газах) двигаются по общим орбиталям, охватывающим весь металлический кристалл. Можно сказать, что электроны становятся общими для всех атомов.
Постоянно перемещаясь между атомами, общие электроны компенсируют взаимное отталкивание положительно заряженных ионов металлов, связывая их между собой.
Можно дать следующее определение металлической связи:
Металлическая связь — это химическая связь, образующаяся между атомами в металлическом кристалле посредством полного обобществления валентных электронов.
Схематически образование металлической связи показано ниже (рис. 5.1), где черные точки символизируют свободные электроны.
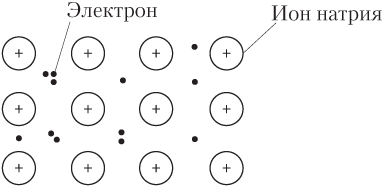
Металлическая связь, подобно ионной связи, ненаправленная и ненасыщаемая, а подобно ковалентной связи — основана на обобществлении электронов, однако степень этого обобществления гораздо выше: посредством ковалентной связи объединены два соседних атома, а посредством металлической — все атомы в кристалле металла. По этой причине металлическую и ионную связь называют коллективной.
Металлическая связь характеризуется длиной (расстоянием между катионами металла) и энергией. Длина металлической связи составляет порядка 0,2–0,5 нм, а энергия — примерно 100–1000 кДж/моль. Мерой энергии металлической связи может служить температура плавления простого вещества металла: чем выше эта температура, тем прочнее металлическая связь. Например, в простом веществе хром металлическая связь прочнее, чем в простом веществе натрий, так как температуры плавления простых веществ этих металлов соответственно равны 1980 °С и 97,9 °С. Металлическая связь возникает также в сплавах металлов (латунь, бронза, дюралюминий и др.).










