Химия
К особому виду межмолекулярного взаимодействия относится водородная связь, которая бывает межмолекулярной и внутримолекулярной.
Межмолекулярная водородная связь — это связь между положительно поляризованным атомом водорода одной молекулы и отрицательно поляризованным атомом другой молекулы.
Внутримолекулярная водородная связь — это связь между положительно поляризованным атомом водорода и отрицательно заряженным другим атомом одной и той же молекулы.
В общем виде образование водородной связи можно представить схемой

где водородная связь, как это принято, показана тремя точками.
Атомы А и В могут быть любыми, но их электроотрицательность должна быть меньше, чем у атомов X и Y. Атомы X и Y — это атомы, электроотрицательность которых гораздо больше, чем у водорода. Как правило, это атомы О, F и N. Таким образом, могут образоваться водородные связи типа:
O–H⋅⋅⋅O (N, F); N–H⋅⋅⋅O (N, F); F–H⋅⋅⋅O (N, F).
Атомы X и Y могут быть одинаковыми (F–Hδ+⋅⋅⋅Fδ−–H) или разными (H2N–H⋅⋅⋅OH2), поэтому водородная связь образуется как между одинаковыми, так и между разными молекулами. Например, межмолекулярная водородная связь образуется между молекулами: воды, карбоновых кислот (рис. 5.3, а, б), спиртов, фтороводорода и аммиака, но не образуется между молекулами алканов, альдегидов, кетонов и бензола. Водородная связь образуется между молекулами аммиака и воды, воды и спирта, воды и альдегида (рис. 5.3, в).
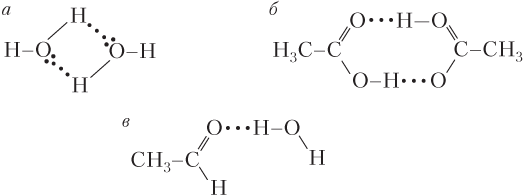
В случае внутримолекулярной водородной связи между собой связываются различные части одной и той же молекулы.
Примеры образования внутримолекулярной водородной связи показаны на рис. 5.4.
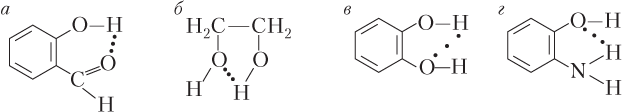
Для образования внутримолекулярных водородных связей необходимо, чтобы функциональные группы, содержащие атомы H и X, находились рядом (на сравнительно небольшом расстоянии); в противном случае внутримолекулярная водородная связь не образуется. Например, внутримолекулярная водородная связь не образуется в молекулах, строение которых показано ниже (отметим, что бензольное кольцо плоское и не может изгибаться):

В случае данных молекул образуется межмолекулярная водородная связь.
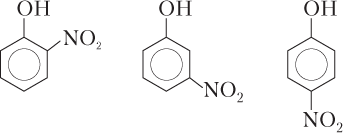
Соединения с внутримолекулярной связью, как правило, менее растворимы, чем их изомеры; обладают более низкими температурами плавления и кипения; имеют меньшую вязкость в жидком состоянии, так как такие молекулы мало связаны с соседними молекулами. Например, среди трех изомерных нитрофенолов о-нитрофенол хуже растворяется в воде и имеет более низкую температуру кипения, так как только в этой молекуле присутствует внутримолекулярная водородная связь.
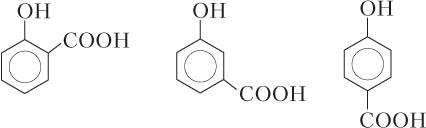
Органические кислоты, у которых кислород карбоксильной группы участвует в образовании внутримолекулярной водородной связи, являются более сильными кислотами, чем их изомеры. Водородная связь облегчает отрыв протона из-за перераспределения электронной плотности. Так, среди трех изомеров гидробензойных кислот наиболее сильной является салициловая (первая слева).
Внутримолекулярная водородная связь образуется в белках между группами NH и CO соседних витков спирали, обеспечивая тем самым устойчивость вторичной структуры белка:

Отметим, что водородная связь присутствует и в кислых солях.
Одна из составляющих при образовании водородной связи — электростатическое диполь-дипольное притяжение положительно заряженного атома водорода и отрицательно заряженного атома другой или той же самой молекулы: большая электроотрицательность атомов X и Y (F, О, N) обусловливает возникновение сравнительно больших по величине зарядов на атомах Н и Y и, соответственно, образование водородной связи. Кроме того, образованию водородной связи способствуют малые размеры атома Н, что позволяет атомам подходить достаточно близко. Другая составляющая водородной связи обеспечивается частичным образованием ковалентной связи по донорно-акцепторному механизму, так как атом Y обычно имеет неподеленные пары электронов, а на атоме Н из-за сильной поляризации электронной плотности под влиянием сильноэлектроотрицательного атома X частично освобождается 1s атомная орбиталь (рис. 5.5).
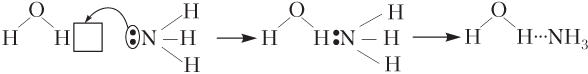
Благодаря ковалентной составляющей водородная связь направленная и насыщаемая, что во многом определяет строение веществ в конденсированном состоянии. Энергия водородной связи значительно меньше энергии химической связи и составляет 5–40 кДж/моль. Особой прочностью отличаются водородные связи −H⋅⋅⋅F− с участием наиболее электроотрицательного атома фтора. Связь в ассоциатах (HF)2 настолько прочная, что фтороводородная кислота практически полностью находится в димеризованном состоянии и способна образовывать кислые соли (см. 12.5).
Водородная связь в несколько раз сильнее обычного межмолекулярного взаимодействия и влияет на температуры кипения и плавления веществ, повышая эти константы. Например, чтобы вещество закипело, т.е. перешло из жидкого состояния в газообразное, необходимо разорвать связи между молекулами (но не в самих молекулах!). Понятно, что с повышением прочности межмолекулярных связей из-за образования водородных связей возрастает и температура кипения.
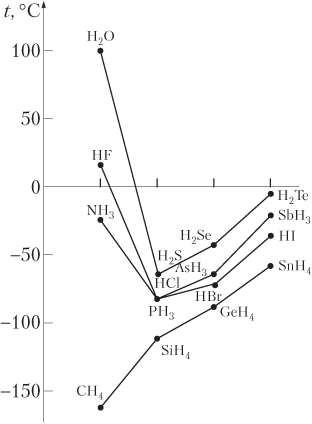
Классической иллюстрацией сказанному служит зависимость температур кипения от молярной массы для водородных соединений неметаллов IVA−VIII-групп (рис. 5.6). В прямо пропорциональную зависимость температуры кипения от массы молекул не укладываются вещества, между молекулами которых образуется водородная связь: вода, аммиак и фтороводород. Для соединений IVA-группы температура кипения с ростом молярной массы закономерно повышается, так как между молекулами водородных соединений элементов данной группы (CH4, SiH4, GeH4 и SnH4) водородные связи не образуются.
Образование водородной связи с молекулами воды повышает растворимость веществ. Например, растворимость этанола C2H5OH в воде гораздо выше изомерного ему диметилового эфира (CH3)2O, так как только в случае спирта образуются водородные связи с водой.
В случае воды образование водородных связей объясняет не только ее аномально высокие температуры кипения и плавления, но и высокие теплоемкость и диэлектрическую проницаемость, а также аномальную зависимость плотности воды от температуры: плотность твердого льда меньше плотности жидкой воды, поэтому зимой водоемы не промерзают до дна. Благодаря высокой теплоемкости (вода долго нагревается и медленно остывает) вода активно участвует в формировании климата на Земле, перенося теплоту на очень большие расстояния. Из-за высокой диэлектической проницаемости и полярности молекул вода является хорошим ионизирующим растворителем (в воде вещества легко распадаются на ионы).
Пример 5.1. Как изменяется температура кипения в ряду веществ, формулы которых: H2, O2, Cl2?
Решение. В этом ряду молярная масса веществ последовательно возрастает, поэтому температура кипения повышается.
Ответ: повышается.
Пример 5.2. Укажите ряд, в котором температура кипения веществ повышается:
1) O3, O2, H2O; 3) O2, O3, H2O;2) H2O, O3, O2; 4) H2O, O2, O3.Решение. Наибольшую температуру кипения из-за образования водородных связей имеет вода. В случае O2 и O3 выше t кип озона (молекулы O3 имеют большую массу). Искомый ряд — ряд 3).
Ответ: 3).
Пример 5.3. Укажите названия веществ, в молекулах которых образуется внутримолекулярная водородная связь: а) фенол; б) 2-гидроксибензойная кислота; в) ацетальдегид; г) 2-нитрофенол.
Решение. Изобразим структурные формулы молекул указанных веществ:
а) 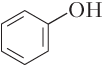

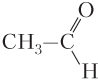
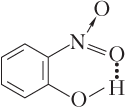
Видим, что внутримолекулярная водородная связь образуется в молекулах 2-гидроксибензойной кислоты и 2-нитрофенола.
Ответ: б), г).










