Физика
В 1913 г. Н. Бор предложил новую модель атома и сформулировал принципиально новые положения, отражающие квантовый характер происходящих процессов, — постулаты Бора.
Согласно первому постулату Бора ( постулату стационарных состояний) атомная система может находиться только в стационарных (неизменяющихся во времени) состояниях, каждому из которых соответствует определенное дискретное значение энергии; в стационарном состоянии атом не излучает электромагнитные волны.
В стационарном состоянии энергия электрона в атоме квантуется, т.е. принимает ряд дискретных (определенных) значений, определяемых формулой
,
где k = 1/4πε0 ≈ 9 ⋅ 109 Н ⋅ м2/Кл2; ε0 — электрическая постоянная, ε0 = 8,85 ⋅ 10−12 Ф/м; Z — зарядовое число; e — заряд электрона, e = = −1,6 ⋅ 10−19 Кл; m — масса электрона, m = 9,11 ⋅ 10−31 кг; ℏ — приведенная постоянная Планка, ℏ = h/2π = 1,055 ⋅ 10−34 Дж ⋅ с; h — постоянная Планка, h = 6,626 ⋅ 10−34 Дж ⋅ с; n — главное квантовое число.
Главное квантовое число n принимает ряд натуральных значений:
1) значение n = 1 соответствует основному состоянию электрона в водородоподобном атоме; энергия основного состояния определяется формулой
,
где Z — порядковый номер химического элемента в Периодической системе элементов Д.И. Менделеева; для атома водорода (Z = 1) значение энергии основного состояния равно:
эВ;
2) значения n = 2, 3, … соответствуют возбужденным состояниям электрона в водородоподобном атоме.
Для упрощения вычислений энергии n-го состояния электрона в атоме применяют формулу
,
где E(эВ) — значение энергии в электронвольтах; n = 1, 2, 3, … — главное квантовое число.
Полная энергия электрона в атоме согласно модели Резерфорда (планетарной модели) определяется формулой
,
где k = 1/4πε0 ≈ 9 ⋅ 109 Н ⋅ м2/Кл2; ε0 — электрическая постоянная, ε0 = 8,85 ⋅ 10−12 Ф/м; Z|e| — заряд ядра; Z — зарядовое число; e — заряд электрона, e = −1,6 ⋅ 10−19 Кл; r — радиус орбиты электрона.
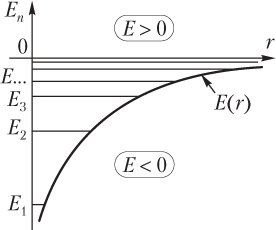
На рис. 13.15 показана соответствующая зависимость E(r).
Согласно модели Бора (квантовой модели) полная энергия электрона в атоме определяется формулой
,
где ℏ — приведенная постоянная Планка, ℏ = h/2π ≈ 1,055 ⋅ 10−34 Дж ⋅ с; h — постоянная Планка, h = 6,626 ⋅ 10−34 Дж ⋅ с; n — главное квантовое число.
На рис. 13.15 соответствующие уровни энергии показаны горизонтальными линиями.
Знак энергии электрона определяется его состоянием:
- при E < 0 электрон находится в связанном состоянии, т.е. в атоме;
- при E > 0 электрон свободен, т.е. он удален от ядра на расстояние, на котором действием кулоновских сил можно пренебречь;
- при E = 0 имеет место ионизация атома, т.е. «отрыв» электрона от атома (или захват электрона положительным ионом и образование нейтрального атома).
Энергия ионизации атома — работа, которую необходимо совершить, чтобы «оторвать» электрон от атома, т.е. перевести атом в область ионизации (E = 0).
Энергия ионизации равна разности энергий электрона в атоме (рис. 13.16):
E i = E 2 − E 1,
где E 1 — энергия начального состояния электрона в атоме, равная энергии того состояния, в котором находится электрон, E 1 = E n ; E 2 — энергия конечного состояния, равная нулю, E 2 = 0.
Энергия ионизации равна модулю энергии состояния, в котором находится электрон в атоме:
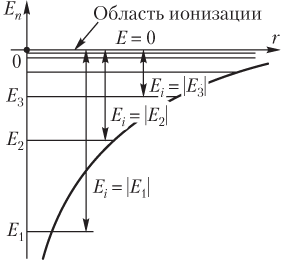
E i = |E n |;
является положительной величиной.
Энергия электрона в атоме:
- квантуется, т.е. принимает ряд дискретных значений (энергетический спектр атома является дискретным);
- всегда отрицательна;
- обратно пропорциональна квадрату главного квантового числа;
- возрастает с увеличением номера главного квантового числа;
- минимальна, когда электрон находится в основном энергетическом состоянии (n = 1);
- увеличивается при переходе электрона в возбужденное состояние (n = 2, 3, 4, …);
- максимальна (E = 0), когда атом находится в области ионизации;
- с увеличением номера главного квантового числа возрастает таким образом, что расстояние между двумя соседними энергетическими уровнями уменьшается;
- при больших значениях главного квантового числа (n → ∞) энергетический спектр атома становится сплошным (т.е. значения энергии двух соседних энергетических уровней практически не отличаются друг от друга).
Пример 19. Энергия основного состояния электрона в атоме водорода составляет −13,6 эВ. Электрон в атоме водорода переходит из состояния с главным квантовым числом n 1 = 2 в состояние с главным квантовым числом n 2 = 3. Рассчитать увеличение энергии электрона при указанном переходе.
Решение. В стационарном состоянии энергия электрона в атоме водорода квантуется:
,
где k = 9,00 ⋅ 109 Н ⋅ м2/Кл2; Z — зарядовое число водорода, Z = 1; e — заряд электрона, e = −1,60 ⋅ 10−19 Кл; m — масса электрона, m e = 9,11 ⋅ 10−31 кг; ℏ — приведенная постоянная Планка, ℏ = 1,06 ⋅ 10−34 Дж ⋅ с; n — главное квантовое число.
Основное состояние определяется значением главного квантового числа, равным единице (n = 1), и значение энергии основного состояния считается известным:
эВ.
Следовательно, энергию электрона в атоме водорода в любом стационарном состоянии (в эВ) можно рассчитать по формуле
.
Значения энергии электрона в атоме водорода: в состоянии с главным квантовым числом
- n 1 = 2 —
эВ;
- n 2 = 3 —
эВ.
При переходе электрона из состояния с главным квантовым числом n 1 = 2 в состояние с главным квантовым числом n 2 = 3 его энергия увеличивается на
∆E = E 3 − E 2 = −1,5 − (−3,4) = 1,9 эВ.










