Химия
Окислительно-восстановительными реакциями ( ОВР) называются реакции, протекающие с изменением степени окисления атомов элементов. В результате этих реакций одни атомы отдают электроны, а другие их принимают.
Восстановитель — атом, ион, молекула или ФЕ, отдающий электроны, окислитель — атом, ион, молекула или ФЕ, принимающий электроны:
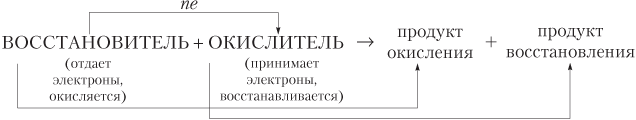
Процесс отдачи электронов называется окислением, а процесс принятия — восстановлением. В ОВР обязательно должны быть вещество восстановитель и вещество окислитель. Нет процесса окисления без процесса восстановления и нет процесса восстановления без процесса окисления.
Восстановитель отдает электроны и окисляется, а окислитель принимает электроны и восстанавливается
Процесс восстановления сопровождается понижением степени окисления атомов, а процесс окисления — повышением степени окисления атомов элементов. Сказанное удобно проиллюстрировать схемой (СО — степень окисления):

Конкретные примеры процессов окисления и восстановления (схемы электронного баланса) приведены в табл. 8.1.
| Схема электронного баланса | Характеристика процесса |
|---|---|
| Процесс окисления | |
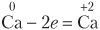 | Атом кальция отдает электроны, повышает степень окисления, является восстановителем |
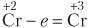 | Ион Cr+2 отдает электроны, повышает степень окисления, является восстановителем |
 | Молекула хлора отдает электроны, атомы хлора повышают степень окисления от 0 до +1, хлор — восстановитель |
| Процесс восстановления | |
 | Атом углерода принимает электроны, понижает степень окисления, является окислителем |
 | Молекула кислорода принимает электроны, атомы кислорода понижают степень окисления от 0 до −2, молекула кислорода является окислителем |
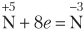 | Ион 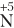 принимает электроны, понижает степень окисления, является окислителем принимает электроны, понижает степень окисления, является окислителем |
Важнейшие восстановители: простые вещества металлы; водород; углерод в форме кокса; оксид углерода(II); соединения, содержащие атомы в низшей степени окисления (гидриды металлов 




Важнейшие окислители: простые вещества — галогены, кислород, озон; концентрированная серная кислота; азотная кислота; ряд солей (KClO3, KMnO4, K2Cr2O7); пероксид водорода H2O2; наиболее сильный окислитель — электрический ток на аноде.
По периоду окислительные свойства атомов и простых веществ усиливаются: фтор — самый сильный окислитель из всех простых веществ. В каждом периоде галогены образуют простые вещества с наиболее выраженными окислительными свойствами.
В группах А сверху вниз окислительные свойства атомов и простых веществ ослабевают, а восстановительные — усиливаются.
Для однотипных атомов восстановительные свойства усиливаются с увеличением их радиуса; например, восстановительные свойства аниона
I− выражены сильнее, чем аниона Cl−.
Для металлов окислительно-восстановительные свойства простых веществ и ионов в водном растворе определяются положением металла в электрохимическом ряду: слева направо (сверху вниз) восстановительные свойства простых металлов ослабевают: самый сильный восстановитель — литий.
Для ионов металлов в водном растворе слева направо в этом же ряду соответственно окислительные свойства усиливаются: наиболее сильный окислитель — ионы Au 3 +.
Для расстановки коэффициентов в ОВР можно пользоваться способом, основанным на составлении схем процессов окисления и восстановления. Этот способ называется методом электронного баланса.
Суть метода электронного баланса состоит в следующем.
1. Составляют схему реакции и определяют элементы, которые изменили степень окисления.
2. Составляют электронные уравнения полуреакций восстановления и окисления.
3. Поскольку число электронов, отданных восстановителем, должно быть равно числу электронов, принятых окислителем, методом наименьшего общего кратного (НОК) находят дополнительные множители.
4. Дополнительные множители проставляют перед формулами соответствующих веществ (коэффициент 1 опускается).
5. Уравнивают числа атомов тех элементов, которые не изменили степень окисления (вначале — водород по воде, а затем — числа атомов кислорода).
Пример составления уравнения окислительно-восстановительной реакции
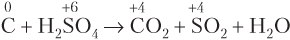
методом электронного баланса.
Находим, что атомы углерода и серы изменили степень окисления. Составляем уравнения полуреакций восстановления и окисления:
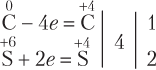
Для этого случая НОК равно 4, а дополнительными множителями будут 1 (для углерода) и 2 (для серной кислоты).
Найденные дополнительные множители проставляем в левой и правой частях схемы реакции перед формулами веществ, содержащих углерод и серу:
C + 2H2SO4 → CO2 + 2SO2 + H2O
Уравниваем число атомов водорода, поставив перед формулой воды коэффициент 2, и убеждаемся, что число атомов кислорода в обеих частях уравнения одинаковое. Следовательно, уравнение ОВР
C + 2H2SO4 = CO2 + 2SO2 + 2H2O
Возникает вопрос: в какую часть схемы ОВР следует поставить найденные дополнительные множители — в левую или правую?
Для простых реакций это не имеет значения. Однако следует иметь в виду: если определены дополнительные множители по левой части уравнения, то и коэффициенты проставляются перед формулами веществ в левой части; если же расчеты проводились для правой части, то коэффициенты ставятся в правой части уравнения. Например:
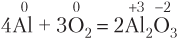
По числу атомов Al в левой части:
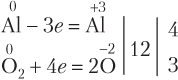
По числу атомов Al в правой части:
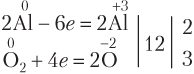
В общем случае, если в реакции участвуют вещества молекулярного строения (O2, Cl2, Br2, I2, N2), то при подборе коэффициентов исходят именно из числа атомов в молекуле:
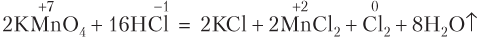
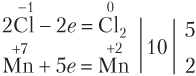
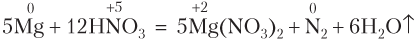
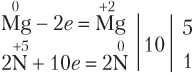
Если в реакции с участием HNO3 образуется N2O, то схему электронного баланса для азота также лучше записывать исходя из двух атомов азота 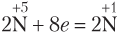
В некоторых окислительно-восстановительных реакциях одно из веществ может выполнять функцию как окислителя (восстановителя), так и солеобразователя (т.е. участвовать в образовании соли).
Такие реакции характерны, в частности, для взаимодействия металлов с кислотами-окислителями (HNO3, H2SO4 (конц)), а также солей-окислителей (KMnO4, K2Cr2O7, KClO3, Ca(OCl)2) с соляной кислотой (за счет анионов Cl− соляная кислота обладает восстановительными свойствами) и другими кислотами, анион которых — восстановитель.
Составим уравнение реакции меди с разбавленной азотной кислотой:

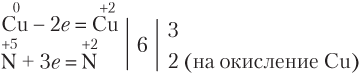
Видим, что часть молекул азотной кислоты расходуется на окисление меди, восстанавливаясь при этом до оксида азота(II), а часть идет на связывание образовавшихся ионов Cu2+ в соль Cu(NO3)2 (в составе соли степень окисления атома азота такая же, как в кислоте, т.е. не изменяется). В таких реакциях дополнительный множитель для элемента-окислителя всегда ставится в правой части перед формулой продукта восстановления, в данном случае — перед формулой NO, а не HNO3 или Cu(NO3)2.
Перед формулой HNO3 ставим коэффициент 8 (две молекулы HNO3 расходуются на окисление меди и шесть — на связывание в соль трех ионов Cu2+), уравниваем числа атомов Н и О и получаем
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O.
В других случаях кислота, например соляная, может одновременно быть как восстановителем, так и участвовать в образовании соли:
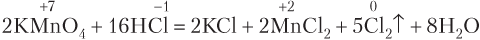
Пример 8.5. Рассчитайте, какая масса HNO3 расходуется на солеобразование, когда в реакцию, уравнение которой
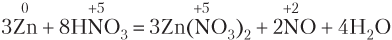
вступает цинк массой 1,4 г.
Решение. Из уравнения реакции видим, что из 8 моль азотной кислоты только 2 моль пошло на окисление 3 моль цинка (перед формулой продукта восстановления кислоты, NO, стоит коэффициент 2). На солеобразование израсходовалось 6 моль кислоты, что легко определить, умножив коэффициент 3 перед формулой соли Zn(HNO3)2 на число кислотных остатков в составе одной формульной единицы соли, т.е. на 2.
Находим:
n(Zn) = 1,4/65 = 0,0215 (моль).

Откуда
x = 0,043 моль;
m(HNO3) = n(HNO3) · M(HNO3) = 0,043 ⋅ 63 = 2,71 (г)
Ответ: 2,71 г.
В некоторых ОВР степень окисления изменяют атомы не двух, а трех элементов.
Пример 8.6. Расставьте коэффициенты в ОВР, протекающей по схеме FeS + O2 → Fe2O3 + SO2, используя метод электронного баланса.
Решение. Видим, что степень окисления изменяют атомы трех элементов: Fe, S и O. В таких случаях числа электронов, отданных атомами разных элементов, суммируются:
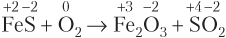
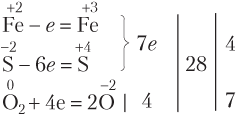
Расставив стехиометрические коэффициенты, получаем:
4FeS + 7O2 = 2Fe2O3 + 4SO2.
Рассмотрим примеры решения других типов экзаменационных заданий на эту тему.
Пример 8.7. Укажите число электронов, переходящих от восстановителя к окислителю при полном разложении нитрата меди(II), массой 28,2 г.
Решение. Записываем уравнение реакции разложения соли и схему электронного баланса ОВР; M[Cu(NO3)2] = 188 г/моль.
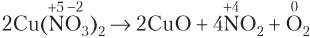
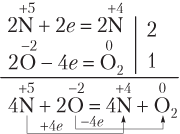
Видим, что 2 моль O2 образуется при разложении 4 моль соли. При этом от атомов восстановителя (в данном случае это ионы 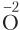


2 моль соли — 4 моль электронов
0,15 моль — x
Находим:
n(e) = x = 4 ⋅ 0,15/2 = 0,3 (моль),
N(e) = N An(e) = 6,02 ⋅ 1023 ⋅ 0,3 = 1,806 ⋅ 1023 (электронов).
Ответ: 1,806 ⋅ 1023.
Пример 8.8. При взаимодействии серной кислоты химическим количеством 0,02 моль с магнием атомы серы присоединили 7,224 ⋅ 1022 электронов. Найдите формулу продукта восстановления кислоты.
Решение. В общем случае схемы процессов восстановления атомов серы в составе серной кислоты могут быть такими:

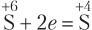

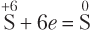


т.е. 1 моль атомов серы может принять 2, 6 или 8 моль электронов. Учитывая, что в состав 1 моль кислоты входит 1 моль атомов серы, т.е. n(H2SO4) = n(S), имеем:
n(e) = N(e)/N A = (7,224 ⋅ 1022)/(6,02 ⋅ 1023) = 0,12 (моль).
Рассчитываем количество электронов, принятых 1 моль кислоты:
0,02 моль кислоты принимают 0,12 моль электронов
1 моль — х
Находим:
n(e) = x = 0,12/0,02 = 6 (моль).
Этот результат соответствует процессу восстановления серной кислоты до серы:
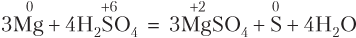
Ответ: сера.
Пример 8.9. В реакции углерода с азотной концентрированной кислотой образуются вода и два солеобразующих оксида. Найдите массу вступившего в реакцию углерода, если атомы окислителя в этом процессе приняли 0,2 моль электронов.
Решение. Взаимодействие веществ протекает согласно схеме реакции
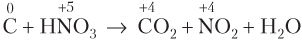
Составляем уравнения полуреакций окисления и восстановления:
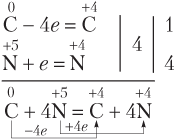
Из схем электронного баланса видим, что если атомы окислителя (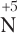
4 моль электронов — 12 г углерода
0,2 — x
(г).
Ответ: 0,6 г.
Различают межмолекулярные и внутримолекулярные окислительно-восстановительные реакции.
В случае межмолекулярных ОВР атомы окислителя и восстановителя входят в состав разных веществ и являются атомами разных химических элементов.
В случае внутримолекулярных ОВР атомы окислителя и восстановителя входят в состав одного и того же вещества. К внутримолекулярным относятся реакции диспропорционирования, в которых окислитель и восстановитель — это атомы одного и того же химического элемента в составе одного и того же вещества. Такие реакции возможны для веществ, содержащих атомы с промежуточной степенью окисления.
Пример 8.10. Укажите схему ОВР диспропорционирования:
1) MnO2 + HCl → MnCl2 + Cl2 + H2O
2) Zn + H2SO4 → ZnSO4 + H2
3) KI + Cl2 → KCl + I2
4) Cl2 + KOH → KCl + KClO + H2O
Решение. Реакции 1)–3) являются межмолекулярными ОВР:
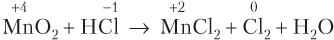


Реакцией диспропорционирования является реакция 4), так как в ней атом хлора и окислитель, и восстановитель:
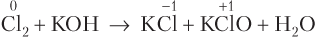
Ответ: 4).
Качественно оценить окислительно-восстановительные свойства веществ можно на основании анализа степеней окисления атомов в составе вещества:
1) если атом, отвечающий за окислительно-восстановительные свойства, находится в высшей степени окисления, то этот атом уже не может отдавать электроны, а может их только принимать. Поэтому в ОВР данное вещество будет проявлять только окислительные свойства. Примеры таких веществ (в формулах указана степень окисления атома, отвечающего за окислительно-восстановительные свойства):
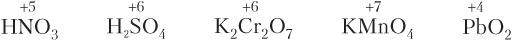
2) если атом, отвечающий за окислительно-восстановительные свойства, находится в низшей степени окисления, то данное вещество в ОВР будет проявлять только восстановительные свойства (принимать электроны данный атом уже не может, он может только их отдавать). Примеры таких веществ: 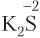


3) если атом элемента находится в промежуточной степени окисления (степень окисления больше минимальной, но меньше максимальной), то соответствующее вещество (ион) будет в зависимости от условий проявлять двойственные окислительно-восстановительные свойства: более сильные окислители будут эти вещества (ионы) окислять, а более сильные восстановители — восстанавливать. Примеры таких веществ: сера 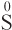
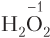
Пример 8.11. Не может протекать окислительно-восстановительная реакция, схема которой:
1) Cl2 + KOH → KCl + KClO3 + H2O
2) S + NaOH → Na2S + Na2SO3 + H2O
3) KClO → KClO3 + KClO4
4)KBr + Cl2 → KCl + Br
Решение. Не может протекать реакция, схема которой указана под номером 3), так как в ней присутствует восстановитель 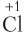
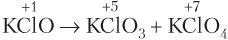
Ответ: 3).
Для некоторых веществ окислительно-восстановительная двойственность обусловлена наличием в их составе различных атомов как в низшей, так и в высшей степени окисления; например, соляная кислота (HCl) за счет атома водорода (высшая степень окисления, равная +1) — окислитель, а за счет аниона Cl− — восстановитель (низшая степень окисления).
Невозможна ОВР между веществами, проявляющими только окислительные (HNO3 и H2SO4, KMnO4 и K2CrO7) или только восстановительные свойства (HCl и HBr, HI и H2S)
ОВР чрезвычайно распространены в природе (обмен веществ в живых организмах, фотосинтез, дыхание, гниение, горение), широко используются человеком в различных целях (получение металлов из руд, кислот, щелочей, аммиака и галогенов, создание химических источников тока, получение тепла и энергии при горении различных веществ). Отметим, что ОВР часто и осложняют нашу жизнь (порча продуктов питания, плодов и овощей, коррозия металлов — все это связано с протеканием различных окислительно-восстановительных процессов).










