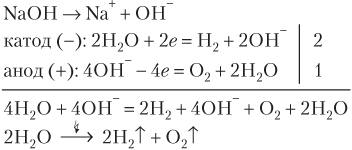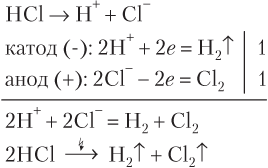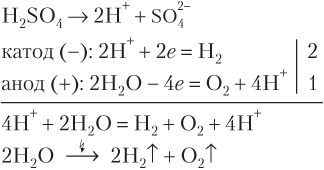Химия
Электролиз — окислительно-восстановительный процесс, протекающий на электродах при прохождении постоянного электрического тока через раствор или расплав электролита.
Принципиальная схема установки для проведения электролиза показана на рис. 8.2.
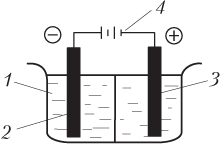
Рассмотрим схему электролиза расплава хлорида калия (отметим, что перевод твердого электролита в жидкое (расплавленное) состояние достигается нагреванием, а не действием электрического тока). В расплавленном состоянии хлорид калия распадается на свободные ионы K+ и Cl−. При включении электрического тока положительно заряженные катионы K+ устремляются к отрицательно заряженному катоду, на котором происходит их восстановление, соответственно отрицательно заряженные анионы Cl− направляются к положительно заряженному аноду, на котором происходит их окисление:
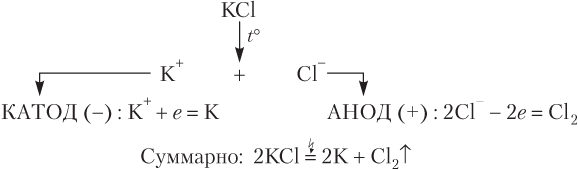
Аналогично выглядят схемы электролиза расплавов галогенидов других металлов, например хлорида меди:
CuCl2
В базовом школьном курсе химии особенности электролиза водных растворов электролитов не рассматриваются, приводятся только результирующие уравнения реакций электролиза галогенидов щелочных металлов, например:
2KCl + 2H2O 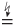
В этом случае в катодном пространстве образуется щелочь, на катоде выделяется водород, а на аноде — хлор.
Аналогично происходит электролиз водных растворов всех солей состава MeX n , где Me — щелочной или щелочноземельный металл, а X — анионы Cl−, Br−, I− (но не F−), S2−.
Если же соль MeX n образована щелочным или щелочноземельным металлом, а анион X — , , и другие оксоанионы, а также F−, то происходит электролиз воды (соль в электролизе не участвует):
2H2O 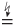
В промышленности электролиз используется для получения щелочей (KOH, NaOH), водорода, галогенов (чаще хлора), активных металлов — щелочных, щелочноземельных и алюминия:
2Al2O3
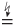
Электролизом воды получают особо чистые водород и кислород. Кроме того, электролизом проводят очистку металлов, полировку их поверхности, покрытие одного металла другим (никелирование, серебрение, хромирование). Осаждением металлов на поверхности изделий занимается гальванотехника, а сами такие покрытия называются гальваническими.
Пример 8.12. При электролизе водного раствора, содержащего BaCl2 химическим количеством 0,1 моль, на электродах выделились газы общей массой 5,11 г. Рассчитайте выход щелочи.
Решение. Записываем уравнение реакции и проводим расчеты:
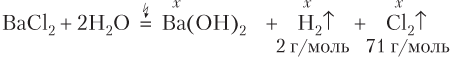
Если образовалось x моль Ba(OH)2, то столько же образовалось по отдельности H2 и Cl2. Имеем:
m(H2) + m(Cl2) = 2x + 71x или 2x + 71x = 5,11 (г).
Откуда
x = 0,07 моль.
Теоретически из 0,1 моль BaCl2 могло образоваться 0,1 моль Ba(OH)2, поэтому выход щелочи:
(70 %).
Ответ: 70 %.
Пример 8.13. Какая масса меди выделилась на катоде при электролизе расплава CuCl2, если катод отдал 0,05 моль электронов?
Решение. На катоде протекает процесс:
Cu2+ + 2e = Cu
Видим, что 1 моль меди образуется, если катод отдал 2 моль электронов.
Находим:
1 моль Cu — 2 моль е
x — 0,05
(моль).
m(Cu) = n(Cu) ⋅ M(Cu) = 0,025 · 64 = 1,6 (г)
Ответ: 1,6 г.
Электролиз водных растворов электролитов — процесс более сложный, чем электролиз расплавов, поскольку в этом случае на электродах могут окисляться или восстанавливаться молекулы воды. Какие именно электрохимические процессы будут протекать на электродах, зависит от природы катиона и аниона электролита. Из нескольких возможных процессов первым будет протекать тот, осуществление которого связано с наименьшей затратой энергии. Иными словами, в первую очередь на катоде будут восстанавливаться более сильные окислители, а на аноде окисляться более сильные восстановители.
На практике для описания процессов, протекающих на катоде в нейтральных средах, можно руководствоваться следующими правилами.
1. Ионы металлов, расположенных в ряду активности от Li+ до Al3+ (включительно), в водных растворах на катоде не восстанавливаются. При электролизе растворов таких электролитов на катоде восстанавливаются молекулы воды:
2Н2О + 2е

Таким образом, щелочные, щелочноземельные металлы, магний и алюминий не могут быть получены электролизом водных растворов своих соединений. Перечисленные металлы в промышленности получают электролизом расплавов.
2. Катионы металлов, расположенных в ряду активности после Al3+ до Н+, восстанавливаются на катоде совместно с молекулами воды.
3. Ионы металлов, расположенных в ряду активности после водорода, восстанавливаются на катоде без участия воды в электрохимическом процессе.
4. Если водный раствор содержит катионы разных металлов, то при электролизе они выделяются на катоде в порядке ослабления их окислительных свойств, т.е. справа налево по ряду активности металлов. Так, из смеси катионов Ag+, Cu2+ и Fe2+ сначала будут восстанавливаться катионы серебра, затем — катионы меди и последними — катионы Fe2+.
Характер процессов на аноде зависит как от природы анионов, так и от материала анода. Различают нерастворимые (инертные) и растворимые аноды.
Нерастворимые аноды изготавливают из угля, графита, платины, золота; такие электроды сами не посылают электроны во внешнюю цепь, а лишь участвуют в их передаче.
При описании процессов на инертных анодах можно руководствоваться следующими правилами:
1. В первую очередь окисляются простые, не содержащие кислород анионы, в порядке ослабления их восстановительных свойств:
S2− → I− → Br− → Cl−
Иными словами, если раствор содержит ионы S2− и Cl−, то сначала на аноде будут окисляться анионы S2−.
2. При электролизе водных растворов, содержащих ионы F−, а также оксоанионы (, , , и др.), на аноде окисляются молекулы воды:
2Н2О − 4е

В щелочных средах на аноде в первую очередь окисляются гидроксид-ионы:
4ОН− − 4е

а в кислых растворах на катоде в первую очередь восстанавливаются катионы водорода:
2Н+ + 2е

Рассмотрим примеры электролиза водных растворов различных соединений металлов с инертным анодом (
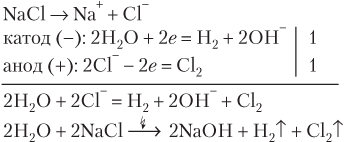
Молекулярное уравнение электролиза получили, связав Cl−-ионы в левой части и OH−-ионы в правой с ионами Na+, которые в электролизе не участвуют.
Таким образом, при электролизе водного раствора NaCl, наряду с выделением водорода и хлора, в катодном пространстве накапливается щелочь (NaОН).
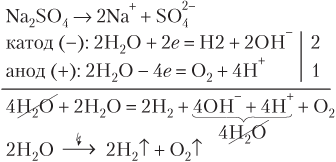
Следовательно, электролиз водного раствора Na2SO4 сводится к разложению воды.
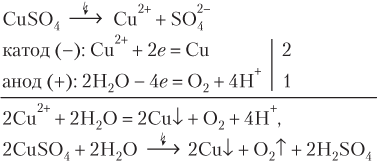
В этом случае, наряду с выделением меди и кислорода, в анодном пространстве образуется серная кислота.
Для сравнения приведем схему электролиза расплава NaOH:
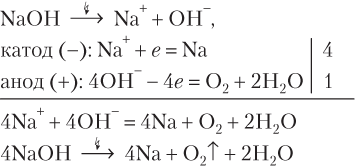
Рассмотрим примеры электролиза растворов солей, катион которых восстанавливается вместе с молекулами воды.
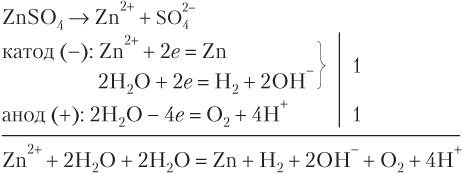
На катоде принято всего четыре электрона — столько же, сколько отдано на аноде, поэтому дополнительные коэффициенты равны единице. В правой части суммарного ионного уравнения две группы OH− и два иона H+ образуют две молекулы воды. Сократив обе части равенства на это число молекул воды, получим:
Zn2+ + 2H2O = Zn + H2 + O2 + 2H+
ZnSO4 + 2H2O 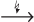
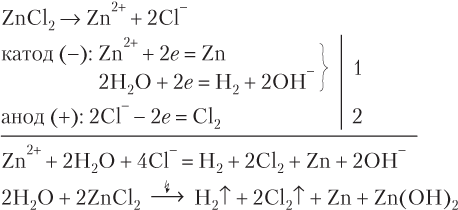
При электролизе с растворимым анодом (анод из меди, никеля, цинка, серебра, железа и других металлов, кроме платины и золота), всегда, независимо от природы аниона, происходит окисление атомов металла, из которого сделан анод. Это объясняется тем, что все металлы (кроме Pt и Au) окисляются легче, чем молекулы воды и анионы кислотных остатков:
Me − ne = Men+.
При этом катионы Men+ переходят в раствор и масса анода уменьшается. Электролиз с растворимым анодом используется для очистки (рафинирования) металлов (меди, никеля и др.). В этом случае анодом является кусок неочищенного металла, а катодом — чистый металл. В процессе электролиза анод растворяется, а перешедшие в раствор катионы металла восстанавливаются на катоде. Пример электролиза водного раствора сульфата меди CuSO4 с медным анодом:
анод (+): Cu0 − 2e = Cu2+ (растворение анода),
катод (−): Cu2+ + 2e = Cu0 (осаждение меди на катоде).
Таким образом, в результате электролиза на катоде выделяется чистая медь.