Химия
Протекание химических реакций сопровождается разрывом связей в исходных веществах (на это энергия затрачивается) и образованием новых связей (при этом энергия выделяется). Поэтому каждая химическая реакция имеет свой тепловой эффект.
Тепловой эффект химической реакции — это количество теплоты, выделяющейся (экзотермические реакции) или поглощаемой (эндотермические реакции) в ходе ее протекания.
Эндотермические реакции протекают за счет поглощения теплоты из окружающей среды, их течение возможно только при постоянном поступлении энергии (теплоты) извне. Экзотермические реакции могут протекать как без предварительного нагревания (горение натрия в хлоре), так и с предварительным нагреванием (поджигом) — горение водорода в кислороде.
Природа теплового эффекта — различие внутренних энергий исходных веществ и продуктов реакции. Тепловой эффект равен разности внутренних энергий исходных веществ и продуктов:
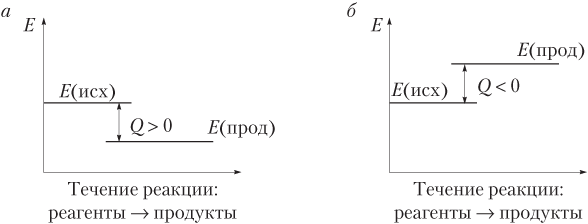
Q = E(исх) − E(прод).
В случае, когда E (исх) > E (прод), реакция экзотермическая (Q > 0). Если же E (исх) < E (прод) — реакция эндотермическая (Q < 0). Схематически это показано на рис. 8.1.
Как уже отмечалось, величина и знак теплового эффекта определяются энергией связей в молекулах реагирующих веществ и продуктов.
Пример 8.2. Энергии связей H–H, N≡N и N–H соответственно равны (кДж/моль) 435, 945 и 390. Найдите тепловой эффект реакции
N2 (г) + 3H2 (г) = 2NH3 (г).
Решение. С учетом стехиометрических коэффициентов и того, что в молекуле аммиака три связи N–H, а в 1 моль молекул аммиака — 3 моль связей N–H, для реакции синтеза аммиака тепловой эффект равен:
Q = E (обр. NH3) − E (обр. N2) = 2 ⋅ 3 ⋅ 390 − 945 − 3 ⋅ 435 = +90 (кДж).
Ответ: +90 кДж.
Уравнения химических реакций, в которых указан тепловой эффект реакции, называются термохимическими.
В термохимических уравнениях часто указывают и агрегатное состояние веществ. Обычно величина теплового эффекта приводится для так называемых стандартных условий: T = 298 K (25 °C), p = 101,3 кПа.
Пример термохимического уравнения:
CaCO3 (тв) = CaO (тв) + CO2 (г) − 178,5 кДж.
Поскольку термохимическое уравнение всегда описывает превращение на макроуровне, стехиометрические коэффициенты в нем могут быть и дробными; соответственно увеличивается или уменьшается тепловой эффект, например, сравните:
H2 (г) + Cl2 (г) = 2HCl (г) + 184 кДж,
1/2H2 (г) + 1/2Cl2 (г) = HCl (г) + 92 кДж.
При записи термохимических уравнений тепловой эффект можно переносить из одной части уравнения в другую, при этом его знак изменяется на противоположный:
N2 (г) + O2 (г) = 2NO (г) − 180 кДж,
N2 (г) + O2 (г) + 180 кДж = 2NO (г).
Тепловой эффект химической реакции зависит:
а) от природы веществ (энергия химических связей в различных веществах разная);
б) массы реагентов: чем больше масса прореагировавших веществ, тем больше выделяется (или поглощается) теплоты;
в) температуры и давления процесса; например, если для протекания реакции температуру нужно повысить, то тепловой эффект экзотермической реакции будет тем меньше, чем выше температура продуктов;
г) природы аллотропной модификации (например, теплота сгорания 1 моль углерода в форме графита больше теплоты сгорания углерода в форме алмаза);
д) агрегатного состояния веществ (например, тепловой эффект сгорания водорода в кислороде с образованием жидкой воды больше, чем в случае этой же реакции, но протекающей с образованием газообразной воды, поскольку внутренняя энергия жидкой воды меньше, чем газообразной).
Тепловой эффект реакции, протекающей в несколько стадий, не зависит от числа промежуточных стадий
С выраженным тепловым эффектом протекают реакции горения. Под горением в широком смысле понимают все быстропротекающие экзотермические реакции, сопровождающиеся ярким свечением (как говорят, появлением пламени).
Вещества горят не только в кислороде; в атмосфере фтора сгорают (самовоспламеняются) алюминий и цинк, в токе хлора — сурьма и железо, а в парах брома — раскаленная медная проволока. Все реакции горения являются окислительно-восстановительными.
Пример 8.3. Согласно термохимическому уравнению реакции
4Al (тв) + 3O2 (г) = 2Al2O3 (тв) + 3352 кДж
определите ее тепловой эффект с участием Al массой 100 г.
Решение. Находим химическое количество алюминия:
n(Al) = m(Al)/M(Al),
n(Al) = 100/27 = 3,7 (моль).
Из термохимического уравнения следует
4 моль Al — 3352 кДж
3,7 моль — Q x
Q x = 3,7 ⋅ 3352/4 = 3101 (кДж).
Ответ: 3101 кДж.
Пример 8.4. На основании термохимического уравнения
C3H6 + 4,5O2 = 3CO2 + 3H2O + 2060 кДж
рассчитайте, какая масса (г) исходной смеси вступила в реакцию, если выделилось 200 Дж теплоты.
Решение. Согласно термохимическому уравнению реагируют 1 моль C3H6 (42 г) и 4,5 моль O2 (144 г), всего 42 + 144 = 186 (г) смеси. Составим пропорцию:
186 г смеси — 2060 кДж
x — 200 кДж.
Находим:
(г).
Ответ: 18,06 г.
В химии часто используется понятие теплота образования вещества, под которой понимают тепловой эффект реакции образования 1 моль вещества из простых веществ при стандартных условиях. Например, из термохимического уравнения
Mg + 1/2O2 = MgO + 600 кДж/моль
следует, что теплота образования 1 моль оксида магния равна 600 кДж.
Для однотипных веществ существует правило: чем больше теплота образования вещества, тем оно устойчивее.
Для веществ, к которым понятие «химическое количество вещества» неприменимо (нефть, древесина, торф, природный газ и т.п.), тепловой эффект относят к 1 кг вещества. Эта величина называется теплотой сгорания топлива.
Топливо — это вещество (или смесь веществ), которое горит с выделением энергии. Топливо бывает жидким (нефть и нефтепродукты), твердым (торф, антрацит, древесина, бурый уголь) и газообразным (природный и попутный нефтяные газы). Теплота сгорания топлива, или теплотворная способность различных веществ, разная: от 9600 кДж/кг для торфа до 44 000 кДж/кг для нефти. Сорта древесины также различаются по теплотворной способности (наименьшая — для осины, наибольшая — для березы, дуба).
Любая химическая реакция протекает с разрывом химических связей в исходных веществах. Этот процесс требует затраты энергии и сопровождается поглощением энергии (теплоты). С другой стороны, в любой химической реакции образуются новые связи в ее продуктах, а при образовании химических связей энергия (теплота) выделяется. Если, например, разрушенные связи (в исходных веществах) менее прочные, чем образовавшиеся (в продуктах реакции), то энергии при образовании продуктов выделится больше, чем было затрачено на разрыв связей в исходных веществах. Тогда можно утверждать, что данная химическая реакция относится к экзотермическим. Для эндотермических реакций, напротив, разрушающиеся связи более прочные, чем образующиеся. Это позволяет утверждать, что тепловой эффект химической реакции Q х можно оценить по разности энергий химических связей в молекулах продуктов и молекулах исходных веществ. Для реакции, протекающей по уравнению
aА–А + bВ–В = сС–С + dD–D
с учетом стехиометрических коэффициентов можно записать:
Q = сЕ (С−С) + dЕ (D−D) − аЕ (А−А) − bЕ (В−В).
Например, в молекулах HCl, Cl2 и H2:
E (H−Cl) = 431,4 кДж/моль;
E (Cl−Cl) = 242,3 кДж/моль;
E (H−H) = 435,9 кДж/моль.
Тогда с учетом химического количества веществ для реакции
H−H + Cl−Cl = 2H−Cl
тепловой эффект
Q = ∑E (H−Cl) − E (Cl−Cl) − E (H−H),
Q = 2 · 431,4 − 435,9 − 242,3 = 184,6 (кДж).
Однако такой способ расчета теплового эффекта реакций в большинстве случаев не применим к соединениям с ионным типом связи, к тому же и для веществ молекулярного строения обычно дает большую погрешность (хотя знак теплового эффекта всегда предсказывается правильно).
Более универсальным является способ расчета теплового эффекта химических реакций, основанный на использовании закона Гесса: тепловой эффект химической реакции не зависит от пути перехода из начального состояния системы в конечное, а определяется только природой и состоянием исходных и конечных веществ
Например, некоторое вещество Б можно получить из вещества А несколькими способами, используя различные химические реакции 1, 2, 3 или 4, 5:
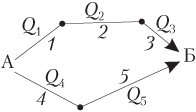
Согласно закону Гесса, можем записать:
Q 1 + Q 2 + Q 3 = Q 4 + Q 5.
Закон Гесса позволяет рассчитывать тепловые эффекты как суммарных процессов, так и промежуточных стадий. Это очень важно в тех случаях, когда экспериментальное определение теплового эффекта затруднено. Например, очень трудно определить тепловой эффект процесса превращения черного фосфора в белый:
Рчерн = Рбел + Q.
Однако достаточно легко экспериментально найти тепловой эффект реакции сгорания черного и белого фосфора:
кДж/моль,
кДж/моль.
Согласно закону Гесса, схему процесса логично представить так:
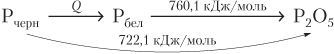
Тогда получим:
722,1 = Q + 760,1,
Q = −38 кДж/моль.
Рассмотрим еще один пример. При окислении серы образуется SO2, а не SO3, поэтому экспериментально невозможно рассчитать тепловой эффект процесса
.
Однако известны тепловые эффекты процессов:
S + O2 = SO2 + 297 кДж, (6)
2SO2 + O2 = 2SO3 + 198 кДж. (7)
Рассчитаем тепловой эффект Q x . Для этого уравнение (6) умножим на 2, имеем:
2S + 2O2 = 2SO2 + 2 · 297 кДж
или
2S + 2O2 = 2SO2 + 594 кДж. (8)
Просуммируем уравнения (7) и (8) и получим:
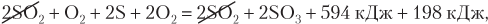
2S + 3O2 = 2SO3 + 792 кДж
или
кДж/моль.
Следовательно, Q х = 396 кДж/моль.
Непосредственно из закона Гесса следует, что тепловой эффект химической реакции равен разности суммы теплот образования продуктов реакции и суммы теплот образования исходных веществ (с учетом химического количества вещества):
Q х = ∑nQ прод − ∑nQ исх.в-в.
При этом теплота образования простых веществ считается равной нулю. Теплоты образования веществ приводятся в специальных справочниках по химии.
Например, требуется рассчитать тепловой эффект реакции
2NO (г) + O2 (г) = 2NO2 (г) + Q x .
В справочнике находим теплоты образования NO2 и NO (теплота образования простого вещества O2 равна нулю):
Q (образ. NO2) = − 33,9 кДж/моль,
Q (образ. NO) = − 91,3 кДж/моль.
Тогда
Q x = 2Q (образ. NO2) − 2Q (образ. NO),
Q x = −2 · 33,9 − (−2 · 91,3) = −67,6 + 182,6 = 115 (кДж).










