Химия
Образование общих электронных пар ковалентной связи может происходить по двум различным механизмам: обменному и донорно-акцепторному.
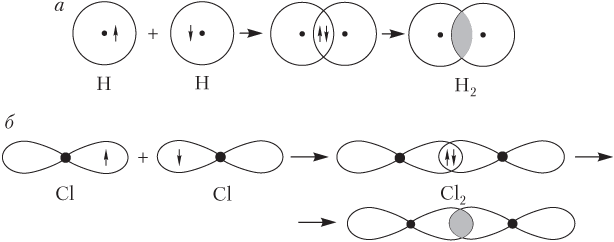
В случае обменного механизма каждый из взаимодействующих атомов дает на образование ковалентной связи один или несколько неспаренных электронов внешнего электронного слоя. Схематически образование ковалентной связи можно показать тремя способами:
- с помощью электронных формул, в которых точками или звездочками символизируются электроны, причем спаренные электроны — это близко расположенные точки (звездочки), а неспаренные — отдельно стоящие:
- с помощью структурных формул, в которых каждую общую электронную пару изображают черточкой между атомами; пары валентных электронов, не участвующие в образовании химической связи (неподеленные электронные пары), — черточками вблизи символов атомов, а неспаренные электроны — отдельно стоящей точкой (точками):

- с помощью схем перекрывания АО взаимодействующих атомов, при этом АО изображают в виде клеток:
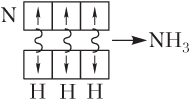
или с конкретным указанием формы перекрывающихся АО (рис. 4.3).
При донорно- акцепторном механизме образования ковалентной связи также формируются общие двухцентровые двухэлектронные связи. Однако в этом случае один из атомов, который называется донором, дает на образование связи готовую пару спаренных электронов, а другой атом — акцептор предоставляет для этой пары электронов вакантную орбиталь.

В качестве доноров выступают молекулы, атомы или ионы, содержащие атомы с неподеленными парами электронов:
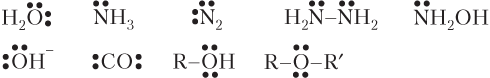
Типичными акцепторами являются: катион H+; соединения В(III) и Al (BH3, BF3, AlCl3), содержащие вакантные АО.
Как будет показано ниже, одни и те же атомы в одном случае могут быть донорами электронов, а в другом — их акцепторами (кислород в молекулах CO и HNO3 соответственно).
Иногда ковалентные связи, образованные по донорно-акцепторному механизму, изображают стрелкой, направленной от донора к акцептору. Следует, однако, всегда помнить, что по своим свойствам эти связи аналогичны связям, образованным по обменному механизму.
Рассмотрим конкретные примеры образования ковалентной связи по донорно-акцепторному механизму.
Образование катиона аммония . Ион образуется при взаимодействии молекулы аммиака и катиона водорода, в реакциях NH3 с кислотами.
В этом случае молекула аммиака — донор электронов, так как у атома азота имеется неподеленная пара электронов (только три из пяти валентных электронов атома азота участвуют в образовании связей с тремя атомами водорода), а ион H+ — акцептор электронов, так как содержит вакантную 1s-АО:
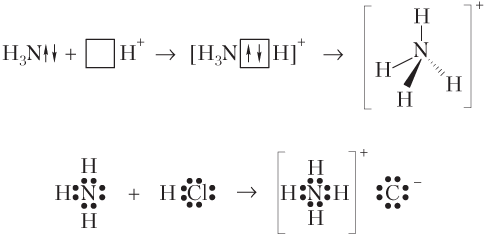
Образование катиона гидроксония . Ион H3O+ образуется при взаимодействии молекулы воды и катиона водорода.
В этом случае в роли донора электронов выступает молекула воды (конкретно — атом кислорода, у которого имеется две неподеленные пары электронов, поскольку из шести валентных электронов на образование связи с атомами водорода затрачено только два):

Образование молекулы оксида углерода(II) CO. Образование связей в этом случае удобно представить, символизируя АО клетками:
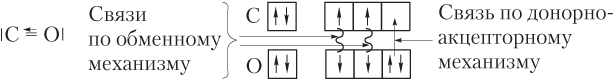
Видим, что в молекуле CO донором электронов является атом кислорода, а акцептором — атом углерода.
Образование молекулы азотной кислоты HNO3. В этом случае предполагается, что один из атомов кислорода переходит в возбужденное состояние О* за счет спаривания 2р-электронов. В результате у этого атома появляется вакантная 2р-АО и он может выступать в роли акцептора электронов, а донором электронов будет атом азота:
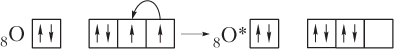 или
или  или
или 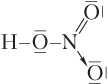
Образование молекулы H3N ⋅ BF 3 . В данном случае молекула аммиака (атом азота) выступает в роли донора электронов, а акцептором является перешедший в возбужденное состояние атом бора:

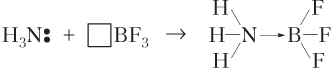
По такому же механизму ковалентная связь (показана точкой) образуется в молекулах BF, H3N ⋅ BH3, H3N ⋅ AlCl3, CH3NH2 ⋅ BF3 и др.
Ковалентная связь по донорно-акцепторному механизму образуется в комплексных гидроксосолях Na2[Be(OH)4], K2[Zn(OH)4], K3[Al(OH)6] и др. В этом случае донорами электронов выступают гидроксогруппы 
Производные аммиака — амины, также участвуют в образовании ковалентных связей по донорно-акцепторному механизму:

Примеры других частиц, в которых есть связи, образованные по донорно-акцепторному механизму:
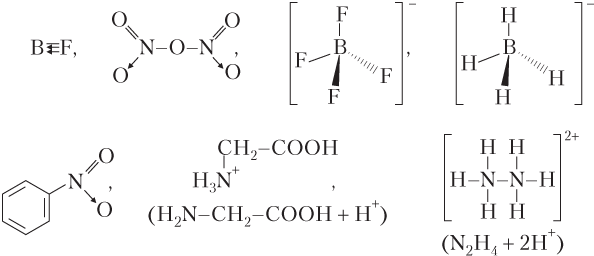
Пример 4.1. Укажите, какие из пар частиц, формулы которых приведены ниже, могут служить донорами электронов при образовании ковалентной связи по донорно-акцепторному механизму:
1) N2, CH4;
2) CO, ;
3) N2, ;
4) CO, H2O.
Решение. Донорами электронов могут быть частицы, содержащие неподеленные пары электронов. Таковыми являются молекулы СО и H2O, а также молекула N2.
Ответ: 4).










