Физика
Процессы, происходящие с определенной массой идеального газа при фиксированном термодинамическом параметре, называются изопроцессами.
При рассмотрении всех изопроцессов (изотермического, изобарного, изохорного) массу идеального газа считают неизменной величиной, т.е.
m = const.
При изотермическом процессе температура фиксированной массы идеального газа (m = const) не изменяется (T = const), тогда произведение давления на объем остается постоянной величиной:
pV = const
— закон Бойля — Мариотта (рис. 5.1).

При решении задач уравнение Менделеева — Клапейрона записывают для двух состояний идеального газа в виде следующей системы:
где p 1, V 1 — давление и объем газа в начальном состоянии; p 2, V 2 — давление и объем газа в конечном состоянии; ν — количество вещества (газа); R — универсальная газовая постоянная, R ≈ 8,31 Дж/(моль ⋅ К); Т — температура газа.
Из системы следует, что
p 1V 1 = p 2V 2.
При изобарном процессе давление фиксированной массы идеального газа (m = const) не изменяется (p = const), тогда отношение объема к температуре остается постоянной величиной:
— закон Гей — Люссака (рис. 5.2).

При решении задач уравнение Менделеева — Клапейрона записывают для двух состояний идеального газа в виде следующей системы:
где T 1, V 1 — температура и объем газа в начальном состоянии; T 2, V 2 — температура и объем газа в конечном состоянии.
Из системы следует, что
.
При изохорном процессе объем фиксированной массы идеального газа (m = const) не изменяется (V = const), тогда отношение давления к температуре остается постоянной величиной:
— закон Шарля (рис. 5.3).
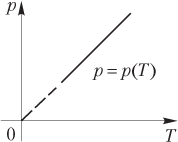
При решении задач уравнение Менделеева — Клапейрона записывают для двух состояний идеального газа в виде следующей системы:
где p 1, T 1 — давление и температура газа в начальном состоянии; p 2, T 2 — давление и температура газа в конечном состоянии.
Из системы следует, что
.
Пример 8. На сколько процентов следует уменьшить объем идеального газа при изотермическом процессе для того, чтобы его давление возросло в 1,60 раза?
Решение. Искомой величиной является отношение
,
где ΔV = V 1 − V 2 — абсолютное уменьшение объема при увеличении давления; V 1 — объем газа при давлении p 1; V 2 — объем газа при давлении p 2.
Преобразуем отношение следующим образом:
.
Для определения отношения объемов дважды запишем уравнение Менделеева — Клапейрона для состояния идеального газа при изотермическом процессе:
- для начального состояния
p 1V 1 = νRT;
- для конечного состояния
p 2V 2 = νRT,
где ν — количество вещества (газа); T — температура газа; R — универсальная газовая постоянная, R ≈ 8,31 Дж/(моль ⋅ К); при записи уравнения состояния газа индекс у температуры не ставим, так как процесс является изотермическим (T = const).
Из системы
следует равенство
p 1V 1 = p 2V 2.
Подставив отношение объемов
в выражение для η, получим искомую величину:
.
Таким образом, для увеличения давления в 1,60 раза при изотермическом процессе объем газа следует уменьшить на 37,5 %.
Пример 9. Идеальный газ находится при температуре 300 К. Сначала изобарически увеличивают в 2 раза объем газа, а затем — изохорически уменьшают в 2 раза его давление. Определить разность температур начального и конечного состояния газа.
Решение. Состояния, которые проходит газ в результате указанных процессов, схематично покажем на рисунке; параметры, не изменяющиеся при переходе из одного состояния в другое, обозначим одинаковыми индексами.
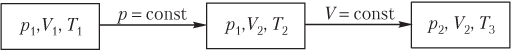
Переход газа из начального состояния в конечное осуществляется в два этапа и описывается парами уравнений:
1) из начального состояния в промежуточное (изобарный процесс) —
где p 1 — давление (постоянное), p 1 = const; V 1 — объем газа в начальном состоянии; ν — количество вещества (постоянная величина, так как изменение состояния газа происходит в результате изопроцессов); R — универсальная газовая постоянная, R = 8,31 Дж/(моль ⋅ К); T 1 — температура газа в начальном состоянии; V 2 — объем газа в промежуточном состоянии; T 2 — температура газа в промежуточном состоянии;
2) из промежуточного состояния в конечное (изохорный процесс) —
где V 2 — объем (постоянный), V 2 = const; p 2 — давление газа в конечном состоянии; T 3 — температура газа в конечном состоянии.
Записанные уравнения состояния образуют систему
из которой следует найти температуру конечного состояния газа T 3 и рассчитать разность
ΔT = T 3 − T 1.
Для определения температуры T 3 разделим третье уравнение системы на первое
и выразим искомую температуру
.
С учетом заданного в условии отношения объемов (V 2 = 2V 1) и давлений (p 1 = 2p 2) имеем:
.
Тогда искомая разность температур
ΔT = T 3 − T 1 = 0,
т.е. в результате указанных процессов температура газа не изменится.
Пример 10. При изотермическом сжатии объем идеального газа уменьшают на 1,0 л, а давление газа при этом возрастает на 20 %. Затем первоначальный объем газа уменьшают на 2,0 л. На сколько процентов при этом увеличивается давление газа?
Решение. Состояния, которые проходит газ в результате двух изотермических процессов, схематично покажем на рисунке, где а, б — первый и второй процессы соответственно.

Параметры, не изменяющиеся при переходе газа из одного состояния в другое, обозначим одинаковыми индексами.
Давление газа при изотермическом сжатии изменяется:
- в первом процессе на
;
- во втором процессе на
,
где p 1 — первоначальное давление газа; p 2 — конечное состояние газа в первом процессе; p 3 — конечное состояние газа во втором процессе.
Искомой величиной является η2; задача сводится к определению отношения p 3/p 1.
Переход газа из начального состояния в конечное в двух изотермических процессах описывается парами уравнений:
- для первого процесса
где p 1 — давление газа в начальном состоянии; V 1 — объем газа в начальном состоянии; ν — количество вещества (постоянная величина); p 2 — давление газа в конечном состоянии; V 2 — объем газа в конечном состоянии; R — универсальная газовая постоянная, R = 8,31 Дж/(моль ⋅ К); T — температура газа.
- для второго процесса
где p 3 — давление газа в конечном состоянии; V 3 — объем газа в конечном состоянии.
Записанные уравнения состояния образуют систему уравнений
из которой следует найти отношение p 3/p 1 и подставить в выражение для η2.
Деление первого и третьего уравнений дает
и сводит задачу к определению отношения объемов V 1/V 3.
Рассчитаем объемы газа в указанных состояниях.
Для расчета объемов V 1 и V 2 запишем пару уравнений состояния для первого процесса, дополнив ее равенством, определяющим ΔV 1 = 1,0 л, т.е.
Решение системы относительно V 1 и V 2 с учетом условия p 2 = 1,2p 1 дает значения:
V 1 = 6,0 л;
V 2 = 5,0 л.
Уравнение
ΔV 2 = V 1 − V 3
с учетом значения ΔV 2 = 2,0 л позволяет вычислить объем V 3:
V 3 = V 1 − ΔV 2 = 6,0 − 2,0 = 4,0 л.
Отношение давлений p 3/p 1 составляет
,
а искомая величина
.
Следовательно, при изотермическом сжатии газа на 2,0 л давление газа возрастает на 50 %.










