Химия
При образовании ковалентной связи АО могут перекрываться по-разному, поэтому различают ковалентные связи σ- и π-типа.
В случае связи σ-связи АО перекрываются вдоль линии, соединяющей ядра атомов (осевое перекрывание):
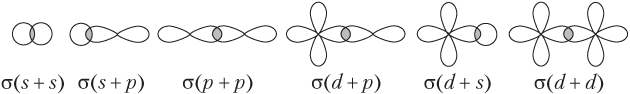
При образовании связи π-типа перекрывание AO осуществляется вне линии, соединяющей ядра атомов (боковое перекрывание):
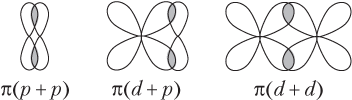
Связи π-типа образуются с участием р- или d-АО; с участием s-AO могут образовываться связи только σ-типа.
Различают одинарные (простые) и кратные связи.
Одинарная связь — это связь, образованная одной парой электронов. Как правило, это σ-связь.
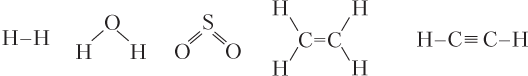
Кратными называются двойные и тройные связи, т.е. связи, образованные соответственно двумя и тремя общими электронными парами. Двойная связь состоит из одной σ- и одной π-связи, а тройная — из одной σ- и двух π-связей (как видим, между двумя атомами максимально может образоваться только одна σ-связь и только две π-связи). Примеры структур молекул с разным числом одинарных и кратных связей:
На рис. 4.4 подробно показано образование связей в молекуле азота.
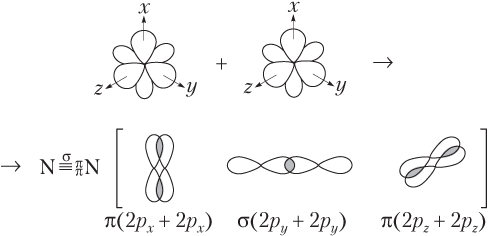
Поскольку электронное облако σ-связи обладает цилиндрической симметрией, вокруг оси данной связи возможно свободное, не разрушающее связь, вращение атомов или атомных групп. Однако вокруг кратных связей такое вращение невозможно, поскольку энергия вращательного движения гораздо меньше, чем энергия π-связи. В случае алкенов это приводит к появлению цис-, транс-изомеров.
При осевом перекрывании АО электронная плотность в межъядерном пространстве больше, чем при боковом. Поэтому σ-связи прочнее, чем π-связи, и как раз по этой причине образуются в первую очередь.
Различают ковалентные полярные и ковалентные неполярные химические связи.
Ковалентная неполярная связь — это связь между атомами неметаллов с одинаковой электроотрицательностью (H2, O2, Cl2, N2 и т.д.). В молекулах с этой связью электронная плотность связи поровну распределена между атомами (нет зарядовых полюсов, связь неполярная), поэтому атомы электронейтральны.
Ковалентная полярная связь — это связь между атомами неметаллов с различной электроотрицательностью. В случае таких молекул общая электронная плотность связи смещена в сторону атома с большим значением χ. В результате на атоме с меньшим значением χ возникает избыточный частичный положительный заряд, а на атоме с большей электроотрицательностью — такой же по величине, но избыточный отрицательный заряд δ− (Hδ+–Clδ−, Pδ+–Fδ−). Такие частичные заряды называются эффективными.
Полярные молекулы называются диполями (имеют два полюса — положительный и отрицательный), условно их обозначают в виде эллипса 
Способность электронного облака смещаться к одному из связанных атомов (поляризация) различна для σ- и π-связей. Легче поляризуется электронное облако π-связи, что оказывает существенное влияние на строение продуктов реакций с участием алкенов (правило Марковникова).
Качественно оценить степень полярности связи можно, сравнивая значения χ атомов, образовавших связь: чем больше ∆χ этих атомов, тем связь более полярная и тем больше величина частичных эффективных зарядов δ на атомах, образовавших связь. Например, связь О−Н более полярная, чем N−H, так как χ(O) > χ(N), а связь H−F более полярная, чем связь Н−О, поскольку χ(F) > χ(O).
Пример 4.2. Укажите наименее полярную химическую связь в молекулах:
1) CH4;
2) HCl;
3) H2O;
4) PH3.
Решение. Записываем в ряд по возрастанию электроотрицательностей χ атомы элементов, образующих указанные вещества,
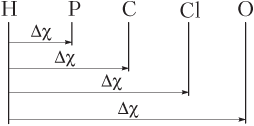
Длина отрезков ∆χ — это разность электроотрицательностей атомов, образовавших химическую связь: чем больше длина отрезка, тем более полярная связь Н−Э, чем она меньше, тем менее полярная связь Н−Э.
Видим, что длина отрезка ∆χ наименьшая в случае элемента фосфора. Таким образом, наименее полярная связь Н−Р.
Ответ: 4).
Полярность отдельных связей следует отличать от полярности молекулы в целом. При этом нужно руководствоваться следующими правилами:
а) двухатомные молекулы с полярной связью (СО, HF, NО) всегда полярные;
б) трехатомные молекулы типа A2B (H2O, CO2, BeH2, BeCl2, SO2, H2S) неполярные, если имеют линейное строение:
O=C=O H–Be–H Cl–Be–Cl
и полярные, если имеют угловое строение:
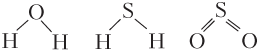
в) четырехатомные молекулы состава A3B неполярные, если имеют форму правильного треугольника:
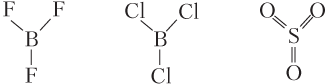
и полярные, если имеют пирамидальное строение:
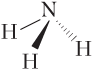
В силу высокой симметрии неполярны молекулы бензола, метана и его тетрагалогенпроизводных с одним и тем же галогеном. Напротив, моногалогенпроизводные бензола, а также производные метана с одним — тремя атомами одного и того же галогена в молекуле будут полярными.










