Химия
Важнейшими характеристиками ковалентной связи являются: длина l, энергия E, направленность, насыщаемость, полярность.
Длина химической связи — это расстояние между ядрами химически связанных атомов. Длина связи тем больше, чем больше радиусы взаимодействующих атомов. Кроме того, длина связи зависит от ее кратности: в ряду однотипных молекул наибольшая длина у одинарной связи, а наименьшая — у тройной. Значения длин химических связей изменяются в пределах 0,1–0,3 нм (1 нм = = 10−9 м).
Под энергией химической связи понимается та энергия, которая выделяется при ее образовании(или затрачивается для разрыва связи). Измеряется энергия связи в килоджоулях на моль. Энергия связи — мера ее прочности: чем больше энергия связи, тем связь прочнее.
Энергия связи зависит:
- от кратности (в ряду одинарная, двойная, тройная энергия связи растет);
- длины (чем длиннее связь, тем меньше перекрываются АО, тем она слабее);
- способа перекрывания АО (как уже отмечалось, σ-связи более прочны, чем π-связи);
- полярности: как правило, более полярные связи более прочные.
Пример 4.3. Укажите формулу молекулы с наиболее прочной связью углерод — кислород:
1) CO2;
2) CO;
3) CH3OH;
4) C6H5OH.
Решение. Изобразим структурные формулы указанных молекул:
O=C=O
C≡O
H3C–O–H
Наиболее прочная связь углерод — кислород в составе молекулы СО, поскольку она в этом случае тройная.
Ответ: 2).
Энергия ковалентных связей составляет порядка 100–1000 кДж/моль. Наиболее прочные тройные связи в молекулах N2 (940 кДж/моль) и СО (1076 кДж/моль).
C ростом кратности связи ее длина уменьшается, а энергия — возрастает
Насыщаемость химической связи означает, что способность данного атома к образованию ковалентных связей не беспредельна, а ограничена вполне определенным максимальным числом. Например, атом водорода может образовать только одну ковалентную связь, а атом углерода — максимально четыре ковалентные связи.
Насыщаемость ковалентной связи обусловлена ограниченным числом валентных электронов (точнее, ограниченными валентными возможностями, если учесть образование связей по донорно-акцепторному механизму) для данного атома (в атоме водорода такой электрон один, а в атоме углерода — четыре).
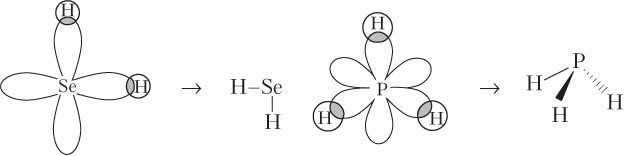
Направленность ковалентных связей означает, что каждая молекула имеет определенное пространственное строение (геометрию, стереохимию). Геометрия молекулы определяется величинами валентных углов связей, т.е. углов между воображаемыми прямыми, проходящими через ядра атомов. Каждая молекула имеет свое строение, так как взаимодействие АО, имеющих определенную форму и взаимную ориентацию, осуществляется не произвольно, а в направлении их максимального перекрывания. Легко объяснить угловую форму молекулы H2Se (s-АО атома Н перекрываются с направленными под углом 90° относительно друг друга 4p-АО атома Se) и пирамидальное строение молекулы фосфина PH3 (s-АО атома Н перекрываются с 3p-АО атома Р, расположенными по осям x, y, z):
В табл. 4.1 приведены структурные характеристики (пространственная конфигурация, тип связей, полярность) некоторых молекул и ионов, а также веществ.
| Формула (название) | Пространственная конфигурация | Характеристика связей, строение молекул |
|---|---|---|
| Н2О (вода) | 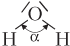 | Молекула имеет угловое строение (α = 105°), полярная (диполь), 2σ-связи по обменному механизму |
| NH3 (аммиак) | 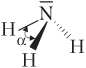 | Молекула имеет пирамидальное строение (α = 107°), полярная (диполь), 3σ-связи по обменному механизму |
| CO2 (оксид углерода(IV)) |  | Молекула имеет линейное строение1 (α = 180°), неполярная, 4 связи (2σ+ 2π) по обменному механизму |
| CH4 (метан) | 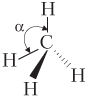 | Молекула имеет тетраэдрическое строение2 (α = 109°), неполярная, 4σ-связи по обменному механизму |
| H2O2 (пероксид водорода) | 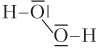 | Молекула полярная, 3 σ-связи по обменному механизму, 2 из них полярные (связи Н–О) |
| P4 (белый фосфор) | 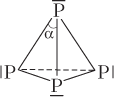 | Тетраэдрическое строение (α = 60°), молекула неполярная, 6 σ-связей по обменному механизму |
| S8 (ромбическая и моноклинная сера) |  | Структура в виде «короны», молекула неполярная, 8 σ-связей по обменному механизму |
| N2H4 (гидразин) |  | Молекула полярная, 5 σ-связей, 4 из них полярные (все по обменному механизму) |
| NH2OH (гидроксиламин) | 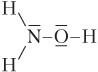 | Молекула полярная. 4 σ-связи (все по обменному механизму) |
| CS2 (сероуглерод) |  | Молекула имеет линейное строение (α = 180°), неполярная, 4 связи (2σ + 2π), все по обменному механизму |
| COF2 | 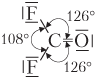 | Молекула треугольная (ядра всех атомов находятся в одной плоскости), полярная, 4 связи (3σ + 1π), все по обменному механизму |
| SO2 (оксид серы(IV)) |  | Молекула имеет угловое строение (α = 120°), полярная, 4 связи (2σ + 2π), все по обменному механизму |
| SO3 (оксид серы(VI)) | 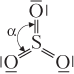 | Молекула имеет вид треугольника (α = 120°), все атомы лежат в одной плоскости4, неполярная, 6 связей (3σ + 3π), все по обменному механизму |
| HCN (циановодород) |  | Молекула имеет линейное строение (α = 180°), полярная, 4 связи (2σ + 2π), все по обменному механизму |
| H3O+(ион гидроксония) | 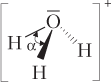 | Ион имеет пирамидальное строение (как NH3), α = 107°, 3 σ-связи: одна по донорно-акцепторному, две — по обменному механизму |
| (ион аммония) | 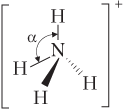 | Ион имеет тетраэдрическое строение (α = 109°), 4 σ-связи: одна по донорно-акцепторному, три — по обменному механизму |
| С6Н6 (бензол) | 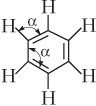 | Валентный угол α равен 120°. Молекула неполярная |
| SiC (карборунд) | 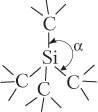 | Тетраэдрическое расположение атомов в пространстве5 (валентный угол 109°) |
| Графит | 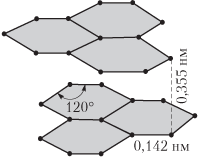 | В графите длина связи С–С, 0,142 нм, валентный угол равен 120° |
| Карбин | 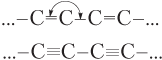 | Валентный угол 180°, длина связи углерод — углерод равна 0,120 нм |
Пример 4.4. Изобразите электронную формулу молекулы CO2.
Решение. Графическая формула молекулы О=С=О (см. табл. 4.1). Учитывая, что каждая связь (независимо, σ- или π-типа) образована парой электронов, а атом кислорода имеет две неподеленные пары электронов (из шести валентных электронов только два участвуют в образовании связей с атомом углерода, а четыре остаются, это как раз и есть две пары), электронная формула СО2 имеет вид











