Химия
Химические реакции классифицируют по различным критериям. Некоторые критерии классификации и соответствующие типы реакций описаны ниже.
Числа и состав исходных веществ и продуктов.
1. Реакции соединения: из двух или нескольких исходных простых или сложных веществ образуется одно новое сложное вещество; эти реакции могут быть как окислительно-восстановительными, так и протекать без изменения степени окисления атомов:
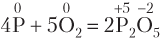

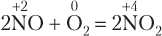
Al(OH)3 + 3KOH = K3[Al(OH)6]
CaO + CO2 = CaCO3
2. Реакции разложения: из одного сложного вещества образуются два и более простых или сложных веществ; эти реакции могут быть как окислительно-восстановительными, так и нет:
2KHCO3


3. Реакции замещения: атомы простого вещества замещают атомы одного из элементов в сложном веществе; в неорганической химии все реакции замещения — окислительно-восстановительные:

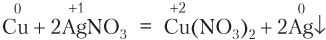
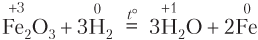
4. Реакции обмена: реакции, в результате которых два сложных вещества обмениваются своими составными частями, образуя два новых сложных вещества; эти реакции протекают без изменения степени окисления атомов элементов (частный случай таких реакций — реакции нейтрализации). Условия протекания реакций обмена в водных растворах: выделение газа, выпадение осадка, образование слабого электролита:
KOH + HCl = KCl + H2O
Na2SO4 + Ba(NO3)2 = BaSO4↓ + 2NaNO3
Тепловой эффект.
1. Экзотермические реакции: протекают с выделением тепла Q (выделение тепла показывают +Q); экзотермическими являются большинство реакций горения и соединения, реакции нейтрализации:
2SO2 + O2 ⇄ 2SO3 + Q
2KOH + H2SO4 = K2SO4 + 2H2O + Q
3H2 + N2 ⇄ 2NH3 + Q
SO3 + H2O = H2SO4 + Q
CH4 + 2O2 = CO2 + 2H2O + Q
2. Эндотермические реакции: протекают с поглощением тепла (поглощение тепла показывается −Q), эндотермическими являются многие реакции разложения, фотосинтез в растениях:
CaCO3

6CO2 + 6H2O 
Пример эндотермической реакции соединения:
N2 + O2

Направление протекания реакции.
1. Необратимые реакции: реакции, протекающие до конца в одном направлении; для реакций обмена условиями необратимости является выпадение осадка, образование слабого электролита или выделение газа:
KOH + HNO3 = KNO3 + H2O
CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl
2H2 + O2 = 2H2O
2. Обратимые реакции: при данных условиях протекают в двух взаимно противоположных направлениях (как говорят, слева направо и справа налево, или в прямом и обратном направлениях, что показывают противоположно направленными стрелками):
2SO2 + O2 ⇄ 2SO3
3H2 + N2 ⇄ 2NH3
CO2 + H2O ⇄ H2CO3
Изменение степени окисления.
1. Окислительно-восстановительные реакции: степени окисления атомов изменяются, так как между ними происходит обмен электронами:
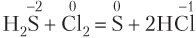

2. Реакции, протекающие без изменения степени окисления атомов элементов (не окислительно-восстановительные):
BaCO3

K2ZnO2 + 4HCl = 2KCl + ZnCl2 + 2H2O.
Участие в реакции катализатора.
1. Каталитические: реакции, протекающие с участием катализатора:
2SO2 + O2 2SO3
3H2 + N2 2NH3
2. Некаталитические реакции: протекают без участия катализатора (например, все реакции ионного обмена):
H2SO4 + Ba(OH)2 = BaSO4↓ + 2H2O
2C2H6 + 5O2 = 4CO2 + 6H2O.
Наличие раздела фаз реагирующих (исходных) веществ.
1. Гомогенные реакции — это реакции между веществами, находящимися в одной фазе, как правило, жидкой или газообразной (агрегатное состояние указывают буквами «г» и «ж»; «р-р» означает, что вещество находится в растворе):
H2 (г) + Cl2 (г) = 2HCl (г)
NaOH (р-р) + HCl (р-р) = NaCl (р-р) + H2O (ж)
NH3 (г) + HCl (г) = NH4Cl (тв)
Гомогенные реакции протекают сразу во всем объеме реакционной смеси (растворе, газовой фазе).
2. Гетерогенные реакции — исходные (реагирующие) вещества находятся в разных агрегатных состояниях либо только в твердом состоянии (твердое или кристаллическое состояние обозначается «тв»):
CaO (тв) + CO2 (г) = CaCO3 (тв)
Zn (тв) + 2HCl (р-р) = ZnCl2 (р-р) + H2 (г)
Cu (тв) + S (тв) = CuS (тв)
В случае гетерогенных реакций химическое взаимодействие протекает только на поверхностях раздела фаз: тв + р-р, тв + г, тв + ж, ж + г, тв + тв.
Одну и ту же реакцию, как правило, можно охарактеризовать сразу по нескольким признакам. Например, реакция, уравнение которой
N2 (г) + 3H2 (г) ⇄ 2NH3,
может рассматриваться одновременно как обратимая каталитическая гомогенная окислительно-восстановительная экзотермическая реакция соединения.
В учебной школьной литературе наблюдается определенная путаница в определении гомогенных и гетерогенных реакций. Одни авторы считают, что гомогенной является реакция, в которой в одной фазе находятся как реагенты, так и продукты, а другие — только реагенты, поэтому одна и та же реакция, например
BaCl2 (р-р) + H2SO4 (р-р) = BaSO4 (тв) + 2HCl (р-р)
в одном случае будет считаться гетерогенной, а в другом — гомогенной.
Данный вопрос хорошо освещен в вузовских учебниках по физической химии (например, А.Г. Стромберг, Д.П. Семченко. Физическая химия / под ред. А.Г. Стромберга. М. : Высшая школа, 1988. С. 289): «В зависимости от фазового агрегатного состояния компонентов (исходных веществ и продуктов) различают реакции гомогенные и гетерогенные, а также гомофазные и гетерофазные. Гомогенными называют реакции, протекающие... во всем объеме... в одной фазе: в смеси газов, в жидком растворе или (реже) в твердой фазе. К гетерогенным относят реакции, протекающие на границе двух фаз».
Авторы подчеркивают, что гомогенными являются реакции, в которых в одной фазе находятся реагирующие вещества (!), т.е. это реакции типа жидкость + жидкость, газ + газ. Именно эти реакции протекают во всем объеме жидкого раствора или газовой смеси, а не на границе раздела фаз. Примеры гомогенных
H2 (г) + Cl2 (г) = 2HCl (г) (1)
AgNO3 (р-р) + KCl (р-р) = AgCl (тв) + KNO3 (р-р) (2)
и гетерогенных реакций
Cu (тв) + S (тв) = CuS (тв) (3)
(реакция протекает не во всем объеме, а по поверхности раздела двух твердых фаз);
Zn (тв) + 2HCl (р-р) = ZnCl2 (р-р) +H2 (г) (4)
(реакция протекает на границе твердой и жидкой фаз);
CuO (тв) +H2 (г) = Cu (г) + H2O (г) (5)
(реакция протекает на границе твердой и газообразной фаз).
Далее авторы подчеркивают, что гомофазными называются реакции, в которых все компоненты (и реагирующие вещества, и продукты — А. Вр.) находятся в одной фазе. К гетерофазным относят реакции, компоненты которых находятся в разных фазах.
Следовательно, реакция (1) является гомофазной, а реакция (2) — гетерофазной.
Таким образом, одна и та же реакция может одновременно классифицироваться как гомогенная и гомофазная [реакция (1)] или как гомогенная и гетерофазная [реакция (2)]. Реакции (3)–(5) являются и гетерогенными, и гетерофазными. Авторы подчеркивают, что «реакцию
CaCO3 (тв) = CaO (тв) + CO2 (г)
следует отнести к гетерогенным гетерофазным реакциям. Реакция протекает на границе двух твердых фаз, причем компоненты находятся в двух разных фазах».
На тип каталитической реакции влияет агрегатное состояние катализатора. Цитируем указанную книгу: «Реакция синтеза аммиака
N2 + 3H2 = 2NH3 (г),
протекающая на поверхности платины, является гетерогенной, так как протекает на границе фаз платина — смесь газов; но она гомофазная, так как все компоненты находятся в газовой фазе (платина является катализатором и в реакции не расходуется)».
Пример 8.1. В реакцию соединения вступают вещества: а) простые; б) сложные; в) простое и сложное; г) только газообразные.
1) а, б, г;
2) а, в;
3) а, б, в;
4) а, б, в, г.
Решение. Правильный ответ — 3). Примеры соответствующих реакций:
а) H2 + Cl2 = 2HCl
б) CaO + CO2 = CaCO3
в) 2NO + O2 = 2NO2
Отметим, что в реакцию соединения могут вступать вещества, находящиеся не только в газообразном состоянии:
S (тв) + O2 (г) = SO2 (г)
Fe (тв) + S (тв) = FeS (тв)
SO2 (г) + H2O (ж) ⇄ H2SO3 (р-р)
Ответ: 3).










