Химия
Нуклид — вид атомов с определенным значением протонного и нуклонного чисел.
К настоящему времени известно более 2500 различных нуклидов. Обозначая нуклид, указывают протонное и массовое число. Например:
Иногда используют только массовое число и название элемента (азот-14, углерод-12) или символ и массовое число (39K).
Для нуклида массовое число лишь приблизительно (!) равно относительной атомной массе: различия обусловлены, во-первых, дефектом масс и, во-вторых, тем, что относительные массы протона и нейтрона примерно (не точно) равны единице. Однако в случае нуклида углерод-12: A = A r = 12 (точно).
Пример 2.1. Укажите число элементарных частиц в атоме нуклида 65Cu.
Решение.
.
Ответ: 94.
Пример 2.2. Рассчитайте число нейтронов в составе нуклида 56Fe.
Решение. Используем формулу (2.2), находим
N(n) = A − Z = 56 − 26 = 30.
Ответ: 30.
Пример 2.3. Суммарное число протонов, нейтронов и электронов в атоме равно 156, при этом число нейтронов на 12 больше, чем протонов. Установите элемент.
Решение.
,
A = N(p) + N(n) = Z + Z + 12.
Имеем
156 = Z + Z + 12 + Z,
откуда
Z = 48.
Это Cd — кадмий.
Ответ: кадмий.
Пример 2.4. Рассчитайте массовую долю нейтронов в нуклиде 63Cu.
Решение. Воспользуемся формулой (2.1) и найдем число нейтронов в нуклиде 63Cu:
N = A − Z, Z(Cu) = 29, N = 63 − 29 = 34.
Суммарная масса нейтронов
.
Масса нуклида 63Cu
.
Находим массовую долю нейтронов:
.
Ответ: 54 %.
Большинство элементов в природе представлены несколькими нуклидами, которые в этом случае имеют различные массовые числа (различное число нейтронов в ядре). Совокупность (плеяда) этих нуклидов называется изотопами.
Изотопы — нуклиды, имеющие одинаковый атомный номер (протонное число), но различные массовые (нуклонные) числа.
Иными словами, изотопы — разновидности атомов одного и того же элемента, имеющие одинаковое число протонов (одинаковое протонное число) и электронов, но разное число нейтронов в ядре (различное массовое число).
С учетом существования изотопов можно сказать, что химический элемент — это совокупность всех нуклидов с одинаковым протонным числом (зарядом ядра).
Изотопы могут быть природными или же полученными в результате ядерных реакций.
Изотопно-чистыми и изотопно-смешанными называют элементы, представленные в природе соответственно только одним или несколькими различными нуклидами. Примеры изотопно-чистых элементов: алюминий (27Al), натрий (23Na), фтор (19F). Изотопно-смешанными элементами являются водород, кислород, олово (природное олово состоит из 12 изотопов). Для изотопно-смешанных элементов значение A r определяют с учетом мольной доли χ каждого из изотопов:
. (2.3)
Пример 2.5. Для элемента магния изотопный состав и мольные доли нуклидов следующие:
;
;
.
Найти A r(Mg).
Решение. Используем формулу (2.3). Имеем:
,
.
Ответ: A r(Mg) = 24,31.
Значение относительных атомных масс элементов рассчитывается с использованием A r (но не A!) и мольных (не массовых!) долей отдельных нуклидов
Для кислорода известны нуклиды с массовыми числами 16, 17 и 18, а водород в природе представлен тремя нуклидами (рис. 2.1): протий (), дейтерий ( или D) и тритий ( или Т). Каждый из нуклидов водорода состоит из одного протона и одного электрона; в ядре протия нейтронов нет, а в ядрах дейтерия и трития их число равно соответственно один и два. В природе преобладают нуклиды , меньше всего нуклидов .
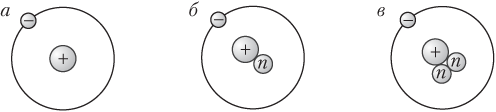
Изотопы занимают одну клетку в периодической системе, их свойства очень похожи (исключение — сильно различающиеся по массе изотопы водорода).










