Химия
Состояние электронов в атоме указывают, используя определенную форму записи. Например, для атома гелия имеем:
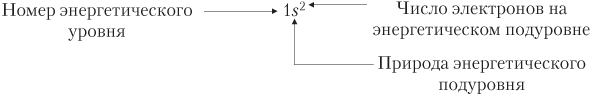
Распределение электронов в атоме указывают с помощью:
а) электронных схем, в которых отмечено только число электронов на каждом слое. Например: Mg 2e, 8e, 2e; Cl 2e, 8e, 7e.
Часто употребляют графические электронные схемы, например, для атома хлора:
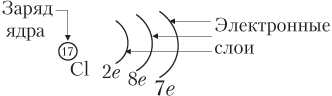
б) электронных конфигураций; в этом случае показаны номер слоя (уровня), природа подуровней и число электронов на них. Например:
Mg 1s22s22p63s2;
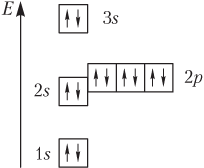
в) электронно-графических схем, на которых орбитали изображают, например, в виде клетки, а электроны — стрелками (рис. 2.6).
Кроме полных формул электронных конфигураций, широко используются сокращенные. В этом случае часть электронной конфигурации, соответствующая благородному газу, указывается символом благородного газа в квадратных скобках. Например: 12Mg[Ne]3s 2, 19K[Ar]4s 1.
Существуют определенные принципы и правила заполнения электронами энергетических уровней и подуровней:
1. Принцип минимума полной энергии атома, согласно которому заселение электронами АО происходит так, чтобы полная энергия атома была минимальной. Экспериментально установлена следующая последовательность заполнения АО:
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p ... .
2. На одной АО может находиться не более двух электронов, причем их спины в этом случае должны быть антипараллельными.
3. В пределах данного энергетического подуровня электроны заполняют АО постепенно, вначале по одному (сначала все вакантные, а уже затем — по два), причем ориентация всех неспаренных электронов должна быть одинаковой, т.е. такой

но не такой

Практически в любом атоме внешними являются только s- и p-АО (рис. 2.7), поэтому на внешнем электронном слое любого атома не может находиться более восьми электронов. Внешний электронный слой, содержащий восемь электронов (в случае гелия — два) называется завершенным.
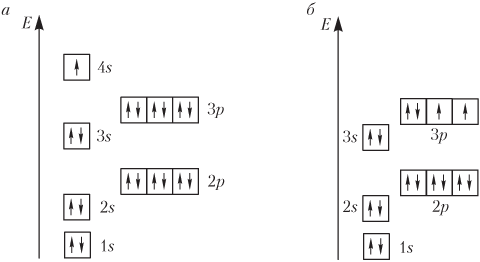
Значения энергий разных энергетических подуровней для различных атомов не являются постоянными, а зависят от заряда ядра Z атома элемента: для атомов элементов с Z = 1–20 Е 3 d > E 4 s и Е 3 d > E 4 p ; для атомов элементов с Z ≥ 21 наоборот: Е 3 d < E 4 s и Е 3 d < E 4 p (рис. 2.8). Кроме того, чем больше Z, тем меньше различаются подуровни по энергии, а кривые, выражающие зависимость энергии подуровней от Z, пересекаются.

Электронные конфигурации атомов (основное состояние) K и Са следующие (см. рис. 2.8):
19K: 1s 22s 22p 63s 23p 64s 1,
20Ca: 1s 22s 22p 63s 23p 64s 2.
Начиная со скандия (Z = 21) заполняется 3d-подуровень, а во внешнем слое остаются 4s-электроны. Общая электронная формула атомов элементов от Sс до Zn — 3d 1−104s 1−2. Например:
21Sс: [Ar] 3d 14s 2,
25Mn: [Ar] 3d 54s 2,
28Ni: [Ar] 3d 84s 2.
30Zn: [Ar] 3d 104s 2.
Для хрома и меди наблюдается проскок (провал) 4s-электрона на 3d-подуровень: Cr — 3d 54s 1, Cu — 3d 104s 1. Такой проскок с ns- на (n − 1)d-подуровень наблюдается также у атомов других элементов (Mo, Ag, Au, Pt) и объясняется близостью энергий ns- и (n − 1)d-подуровней, а также стабильностью наполовину и полностью заполненных d-подуровней.
Дальше в 4-м периоде после 10 d-элементов следуют от Ga ([Ar] 3d 104s 24p 1) до Kr ([Ar] 3d 104s 24p 6) p-элементы.
Образование катионов d-элементов связано с потерей сначала внешних ns-, затем (n − 1)d-электронов, например:
Ti: 3d 24s 2 Ti2+: 3d 2 Ti3+: 3d 1
Mn: 3d 54s 2 Mn2+: 3d 5 Mn4+: 3d 3
Отметим, что в формулах электронных конфигураций принято записывать сначала все электроны с меньшим значением n, а затем переходить к указанию электронов с более высоким значением главного квантового числа. Поэтому порядок заполнения и порядок записи энергетических подуровней для 3d-элементов не совпадают. Например, в электронной формуле атома скандия 3d-орбиталь указана до 4s-орбитали, хотя раньше заполняется 4s-орбиталь.
Возникает закономерный вопрос: почему в атомах 3d-элементов раньше заполняется 4s-подуровень, хотя его энергия больше энергии 3d-подуровня? Почему, например, атом Sc не имеет в основном состоянии электронную конфигурацию 1s 22s 22p 63s 23p 63d 3?
Это происходит потому, что соотношение энергий различных электронных состояний атома не всегда совпадает с соотношением энергий отдельных энергетических подуровней. Энергия 4s-подуровня для 3d-элементов больше энергии 3d-подуровня, но энергия состояния
[Ar] 3d14s2 меньше энергии состояния [Ar] 3d
3.
Объясняется это тем, что межэлектронное отталкивание, а соответственно и энергия всего состояния для конфигурации ...3d 3 (с тремя электронами на одном и том же энергетическом подуровне) больше, чем для конфигурации ...3d 14s 2 (с тремя электронами, находящимися на разных энергетических уровнях).










