Химия
Наиболее важной характеристикой состояния электрона в атоме является энергия электрона, которая согласно законам квантовой механики изменяется не непрерывно, а скачкообразно, т.е. может принимать только вполне определенные значения. Таким образом, можно говорить о наличии в атоме набора энергетических уровней.
Энергетический уровень — совокупность АО с близкими значениями энергии.
Энергетические уровни нумеруют с помощью главного квантового числа n, которое может принимать только целочисленные положительные значения (n = 1, 2, 3, ...). Чем больше значение n, тем выше энергия электрона и данного энергетического уровня. Каждый атом содержит бесконечное число энергетических уровней, часть из которых в основном состоянии атома заселена электронами, а часть — нет (эти энергетические уровни заселяются в возбужденном состоянии атома).
Электронный слой — совокупность электронов, находящихся на данном энергетическом уровне.
Иными словами, электронный слой — это энергетический уровень, содержащий электроны.
Совокупность электронных слоев образует электронную оболочку атома.
В пределах одного и того же электронного слоя электроны могут несколько различаться по энергии, в связи с чем говорят, что энергетические уровни расщепляются на энергетические подуровни (подслои). Число подуровней, на которые расщепляется данный энергетический уровень, равно номеру главного квантового числа энергетического уровня:
N (подур) = n (уровн). (2.4)
Подуровни изображаются с помощью цифр и букв: цифра отвечает номеру энергетического уровня (электронного слоя), буква — природе АО, формирующей подуровни (s-, p-, d-, f-), например: 2p-подуровень (2p-АО, 2p-электрон).
Таким образом, первый энергетический уровень (рис. 2.5) состоит из одного подуровня (1s), второй — из двух (2s и 2p), третий — из трех (3s, 3p и 3d), четвертый из четырех (4s, 4p, 4d и 4f) и т.д. Каждый подуровень содержит определенное число АО:
N(AO) = n 2. (2.5)
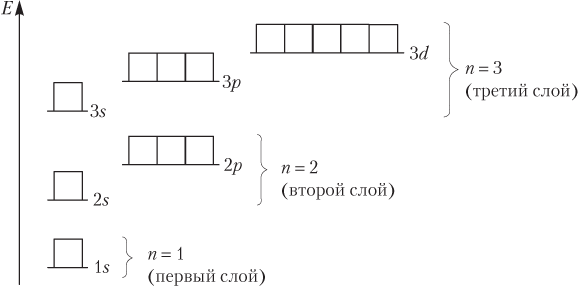
1. АО s-типа имеются на всех энергетических уровнях, p-типа появляются начиная со второго энергетического уровня, d-типа — с третьего, f-типа — с четвертого и т.д.
2. На данном энергетическом уровне может быть одна s-, три p-, пять d-, семь f-орбиталей.
3. Чем больше главное квантовое число, тем больше размеры АО.
Поскольку на одной АО не может находиться более двух электронов, общее (максимальное) число электронов на данном энергетическом уровне в 2 раза больше числа АО и равно:
N(e) = 2n 2. (2.6)
Таким образом, на данном энергетическом уровне максимально может быть 2 электрона s-типа, 6 электронов р-типа и 10 электронов d-типа. Всего же на первом энергетическом уровне максимальное число электронов равно 2, на втором — 8 (2 s-типа и 6 р-типа), на третьем — 18 (2 s-типа, 6 р-типа и 10 d-типа). Эти выводы удобно обобщить в табл. 2.2.
| Номер энергетического уровня n | Энергетические подуровни, число которых равно n | Число орбиталей каждого типа на энергетическом подуровне | Общее число орбиталей, n 2 | Максимальное число электронов 2n 2 |
|---|---|---|---|---|
| 1 | 1s | 1 ( ) ) | 1 | 2 |
| 2 | 2p | 1 ( ) )3 (  ) ) | 4 | 8 |
| 3 | 3d | 1 ( ) )3 (  ) )5 (  ) ) | 9 | 18 |
| 4 | 4f | 1 ( ) )3 (  ) )5 (  ) )7 (  ) ) | 16 | 32 |










