Химия
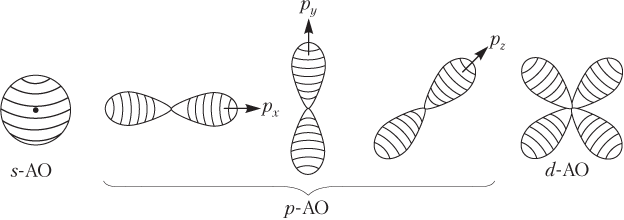
АО имеют различную форму, размеры, энергию и ориентацию в пространстве, а соответственно, и различное обозначение (рис. 2.3).
АО, на которой отсутствуют электроны, называется свободной (вакантной, незанятой).
На одной АО может находиться не более двух электронов. АО, на которой расположен один электрон, называется наполовину занятой, а электрон на ней — неспаренным.
АО, на которой находятся два электрона, называется занятой, а электроны на ней — спаренными. Если спаренные электроны являются валентными, но не вовлекаются в образование химической связи, то их называют неподеленной парой электронов. Существенно, что для двух электронов на одной и той же АО спины должны быть противоположно направленными (антипараллельными). Различные случаи заселения АО электронами показаны на рис. 2.4.

Размер орбитали зависит от энергии электрона: чем больше энергия электрона (т.е. чем дальше от ядра он находится), тем больше размеры АО. Энергия связи электрона с ядром, напротив, тем больше, чем ближе к ядру он находится. Существенно, что электронная плотность с ростом размеров АО уменьшается, поэтому более прочные химические связи образуются с участием АО, расположенных ближе к ядру.










