Химия
Рассмотрим примеры типичных экзаменационных задач, которые решаются по химической формуле и уравнению химической реакции.
Пример 1.8. Найдите число атомов водорода в порции воды объемом (н.у.) 1 см3.
Решение. При нормальных условиях вода — жидкость, поэтому для нахождения ее химического количества формулу (1.17) со значением V m = 22,4 дм3/моль использовать нельзя.
Вначале найдем массу воды, учитывая, что плотность жидкой воды равна 1 г/см3:
m(H2O) = V(H2O)ρ(H2O),
.
Далее имеем
,
M(H2O) = 18 г/моль;
(моль).
Поскольку в одной молекуле воды содержится два атома водорода, находим:
n(H) = 2n(H2O) = 0,0556 · 2 = 0,111 (моль).
По формуле (1.6) рассчитываем:
N(H) = n(H) · N A = 0,111 · 6,02 · 1023 = 6,68 · 1023 (атомов).
Ответ: 6,68 · 1023 атомов.
Пример 1.9. Взаимодействуют водород массой 12 г и азот объемом (н.у.) 67,2 дм3. Найдите: а) объем полученного аммиака; б) массу непрореагировавшего реагента.
Решение. а) Это задача на тему «избыток — недостаток». Рассмотрим принципы решения таких задач.
Найдем химическое количество реагентов:
(моль),
(моль)
и запишем уравнение реакции
N2 + 3H2 = 2NH3
Делением найденных химических количеств на стехиометрические коэффициенты определим, какое из веществ будет в избытке:
моль;
моль.
Видим, что . Следовательно, азот взят с избытком, расчеты проводим по веществу, находящемуся в недостатке, т.е. по водороду:
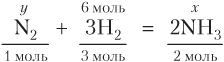
Из уравнения реакции следует:
(моль),
V(NH3) = n(NH3) · V m = 4 · 22,4 = 89,6 (дм3).
б) Найдем массу непрореагировавшего азота. Из уравнения реакции видно, что прореагировал азот химическим количеством:
(моль).
Следовательно, не прореагировал азот химическим количеством
3 − 2 = 1 (моль)
или
m(N2)непрор = n(N2)M(N2) = 1 · 28 = 28 (г).
Ответ: а) 89,6 дм3; б) 28 г.
Пример 1.10. Какую массу железа можно получить из оксида железа(III) массой 100 г при выходе железа 80 %?
Решение. Находим химическое количество оксида железа(III):
(моль).
Записываем стехиометрическую схему реакции:
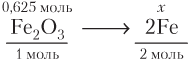
Рассчитываем теоретическое химическое количество железа:
(моль).
С учетом выхода η находим практическое химическое количество железа:
n(Fe)практ = n(Fe)теор · η = 1,25 · 0,80 = 1,0 (моль).
Искомая масса железа:
m(Fe) = n(Fe)практ · M(Fe) = 1 · 56 = 56 (г).
Ответ: 56 г.
Пример 1.11. При нагревании технической питьевой соды массой 28,7 г был получен углекислый газ объемом (н.у.) 3,36 дм3. Рассчитайте массовую долю примесей в технической питьевой соде.
Решение. Находим химическое количество CO2:
(моль).
Записываем уравнение реакции и проводим расчеты:
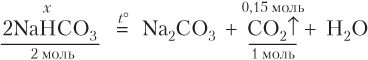
(моль);
m(NaHCO3) = n(NaHCO3) · M(NaHCO3) = 0,3 · 84 = 25,2 (г).
Находим массу и массовую долю примесей:
m (прим) = m(NaHCO3)техн – m(NaHCO3) = 28,7 − 25,2 = 3,5 (г),
.
Ответ: 12,2 %.
Пример 1.12. Рассчитайте массу порции этана C2H6, содержащей атомы углерода массой 2,00 г.
Решение. Находим химическое количество атомов углерода:
n(C) = m(C)/M(C) = 2/12 = 0,167 (моль).
Составляем стехиометрическую схему и проводим расчеты:

(моль);
m(C2H6) = n(C2H6) · M(C2H6) = 0,0835 · 30 = 2,51 (г).
Ответ: 2,51 г.
Пример 1.13. Масса молекулы мышьяка равна 4,98 · 10−22 г. Найдите число атомов в молекуле мышьяка.
Решение. Представим формулу молекулы как As x .
(атома).
Ответ: 4 атома.
Пример 1.14. Рассчитайте число атомов водорода в порции аммиака объемом (н.у.) 2,0 дм3.
Решение. Находим химическое количество аммиака:
(моль).
Составляем стехиометрическую схему и проводим расчеты:
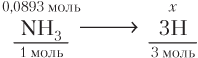
(моль);
N(H) = n(H) · N A = 0,286 · 6,02 · 1023 = 1,61 · 1023 атомов.
Ответ: 1,61 · 1023 атомов.










