Химия
Химическое количество вещества. Моль. Молярная масса
Характеризуя порцию взятого вещества, используют его массу или объем. Однако с этой же целью можно указать и число структурных единиц во взятой порции вещества. Знать это число чрезвычайно важно, так как в химических реакциях вещества взаимодействуют в отношениях, пропорциональных именно числу структурных единиц, а не массам. Например, запись 2H2 + O2 = 2H2O обозначает, что числа (но не массы!) реагирующих молекул H2 и O2 относятся соответственно как 2 : 1.
Для удобства подсчета числа структурных единиц, содержание которых в любой измеримой порции вещества огромно, была введена новая физическая величина — количество вещества, которую при химических расчетах называют также химическим количеством вещества.
Химическое количество вещества — физическая величина, пропорциональная числу структурных единиц (атомов, молекул, ФЕ), содержащихся в данной порции вещества.
Обозначается химическое количество буквой n (реже ν).
Единицей химического количества вещества является моль.
Моль — порция вещества, содержащая столько его элементарных структурных единиц, сколько атомов содержится в порции нуклида С-12 массой 12 г.
Число атомов в указанной порции нуклида С-12 примерно равно 6,02 ⋅ 1023. Физическая величина, равная 6,02 ⋅ 1023 моль−1, называется постоянной Авогадро и обозначается N A:
.
Единицу числителя в величине N A не указывают, так как для разных случаев она может быть разная, например:
,
,
.
Физический смысл постоянной Авогадро состоит в том, что ее численное значение (6,02 ⋅ 1023) показывает число структурных единиц в 1 моль вещества. Например, 1 моль натрия (m = 23 г) содержит 6,02 ⋅ 1023 атомов Na; 1 моль серной кислоты (m = 98 г) содержит 6,02 ⋅ 1023 молекул H2SO4; 1 моль карбоната кальция (m = 100 г) содержит 6,02 ⋅ 1023 формульных единиц CaCO3.
Моль — это порция вещества, содержащая 6,02 ⋅ 1023 его структурных единиц
Число структурных единиц вещества N(B) и химическое количество вещества n(B) связаны соотношением
, (1.8)
откуда
N(B) = n(B)N A. (1.9)
Зная химическое количество любого вещества, можно по его химической формуле рассчитать химическое количество входящих в его состав отдельных атомов.
Один моль любого вещества численно содержит такое же химическое количество атомов, сколько их (атомов) содержится в одной молекуле (формульной единице) вещества
Например:
- в составе молекулы Р4 содержится 4 атома Р, а в составе 1 моль P4 — 4 моль атомов P;
- в составе формульной единицы Na3PO4 содержится 3 атома Na, 1 атом Р и 4 атома О, а в 1 моль Na3PO4 — 3 моль атомов Na, 1 моль атомов P и 4 моль атомов O.
С увеличением (уменьшением) химического количества вещества пропорционально возрастает (уменьшается) химическое количество входящих в его состав атомов. Например: 0,5 моль Na3PO4 содержит 3 · 0,5 = 1,5 (моль) атомов Na; 5 моль Р4 содержит 5 · 4 = = 20 (моль) атомов Р.
Для подобных расчетов можно использовать и так называемые стехиометрические схемы. Принципы составления стехиометрических схем и проведения расчетов показаны на примере K2SO4 химическим количеством 0,3 моль:
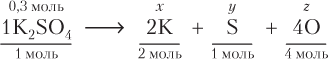
(моль);
(моль);
(моль).
Понятие моль применимо ко всем веществам, а понятие молекула — не ко всем, а только к веществам молекулярного строения. Например, оба понятия применимы в отношении воды (вода имеет молекулярное строение), но в случае карбоната кальция (немолекулярное строение) применимо только понятие «моль».
Понятие «моль» используется также и в случае ионов, электронов, протонов, нейтронов и химических связей. Например, если , то
(моль);
или
,
тогда
;
2 моль молекул Н2 (Н–Н) содержат 2 моль связей водород — водород, а 3 моль молекул Н2О (Н–О–Н) — 6 моль связей Н–О (в каждой молекуле содержится две связи Н–О).
Молярная масса М(В) — физическая величина, равная отношению массы вещества к его химическому количеству:
. (1.10)
Из выражения (1.10) следуют формулы для расчета массы вещества:
m(B) = n(B) ⋅ M(B) (1.11)
и его химического количества:
. (1.12)
Поскольку при n(B) = 1 моль численные значения n(B) и M(B) совпадают, часто говорят, что молярная масса — это масса 1 моль вещества. Это, конечно же, неверно, так как совпадают только численные значения этих величин, а их физический смысл и единицы измерения разные.
С помощью молярной массы можно легко рассчитать массу молекулы или формульной единицы вещества:
. (1.13)
Кроме того, молярную массу можно найти по формуле
. (1.14)
Нетрудно показать, что при использовании единицы молярной массы грамм на моль ее численное значение совпадает:
- с A r для простых веществ атомного строения:
A r(O) = 16, ;
- M r сложных веществ молекулярного и немолекулярного строения:
M r(H2O) = 18, ;
M r(KOH) = 56, .
В самом деле:
или
.
Пример 1.5. Масса молекулы вещества равна 7,31 ⋅ 10−23 г. Рассчитайте молярную массу вещества.
Решение. Первый способ. Из формулы (1.14) следует:
M(B) = m мол(B) ⋅ N A
или
г/моль.
Второй способ. Используем формулу (1.5):
;
M(B) = 44 г/моль.
Ответ: 44 г/моль.
Газовые законы. Смеси газов
Вещества могут находиться в трех агрегатных состояниях: газообразном, жидком и твердом. Жидкое и твердое состояния называются конденсированными. Для большинства веществ агрегатные состояния взаимопереходящие: при нагревании твердое вещество вначале плавится, затем испаряется; при охлаждении газ вначале конденсируется — переходит в жидкое состояние, затем жидкость замерзает (кристаллизуется). Повышение давления и понижение температуры способствуют переходу вещества в конденсированное состояние с меньшим объемом (и наоборот — понижение давления и повышение температуры способствуют переходу вещества в газообразное состояние).
Давление газа в закрытом сосуде прямо пропорционально числу его молекул (или химическому количеству)
При переходе вещества из твердого состояния в жидкое, а затем — в газообразное расстояние между частицами последовательно возрастает, и в случае газа это расстояние в сотни раз больше размеров самих молекул. Из этого следует, что объем порции газа определяется не природой газа (размером его молекул), а расстоянием между молекулами (по существу, объем, который занимает газ, это объем свободного пространства между молекулами).
Расстояние между молекулами газа зависит от температуры и давления, а это означает, что при одинаковых внешних условиях расстояние между молекулами различных газов одинаковое.
Отсюда следует положение, известное как закон Авогадро (1811): в равных объемах различных газов при одинаковых условиях содержится одинаковое число молекул
Из закона Авогадро вытекают три следствия.
1. Одинаковое число молекул различных газов при одинаковых давлении и температуре занимают одинаковый объем.
2. При нормальных условиях (н.у.: Т = 273 К или 0 °С, p = 101,3 кПа) объем порции любого газа химическим количеством 1 моль, или молярный объем V m,
V m = 22,4 дм3/моль.
3. Массы одинаковых объемов двух газов относятся как их молярные (относительные молекулярные) массы. Это отношение называется относительной плотностью газа А по газу В и обозначается как D B(A):
. (1.15)
С использованием V m находят объем и химическое количество газа:
V(B) = n(B) ⋅ V m; (1.16)
n(B) = V(B)/V m. (1.17)
Формула (1.15) позволяет, зная относительную плотность неизвестного газа Х по известному газу, находить M(M r) неизвестного газа:
M(X) = D B(X) ⋅ M(B). (1.18)
Например, если относительная плотность газа Х по воздуху (М возд = 29 г/моль) равна 1,517, то молярная масса этого газа
M(X) = 29 ⋅ 1,517 = 44 (г/моль).
Относительная плотность — величина безразмерная и не зависит от температуры и давления.
Зная молярную массу газа, можно легко рассчитать плотность ρ газа (в г/дм3):
. (1.19)
Например, для азота
г/дм3.
По плотности газа находят его молярную массу:
M(В) = ρ(В)V m. (1.20)
Плотность газа зависит от температуры Т и давления Р: с ростом Т и уменьшением Р плотность уменьшается.
Если равны плотности ρ двух газов (ρ1 = ρ2), то равны и их молярные (относительные молекулярные) массы, т.е. M 1 = M 2 (и наоборот — если равны молярные массы газов, то равны и их плотности)
В случае газов справедлив также закон объемных отношений Гей-Люссака (1805–1808): в химических реакциях объемы реагирующих и полученных газов относятся как небольшие целые числа, равные их стехиометрическим коэффициентам
Например, для реакции
4NH3 + 5O2 = 4NO + 6H2O
имеем
;
.
Пример 1.6. Относительная плотность (н.у.) некоторого газа X по аргону равна 1,2. Найдите массу молекулы газа X.
Решение. Используя формулу (1.18), найдем молярную массу газа Х:
,
г/моль.
По формуле (1.13) рассчитаем массу молекулы газа X:
(г).
Можно использовать также формулу (1.7):
(г).
Ответ: 7,97 ⋅ 10−23 г.
Способы собирания газов. Молярная концентрация газа
Рассмотрим лабораторные способы собирания газов. Таких способов два (рис. 1.1).
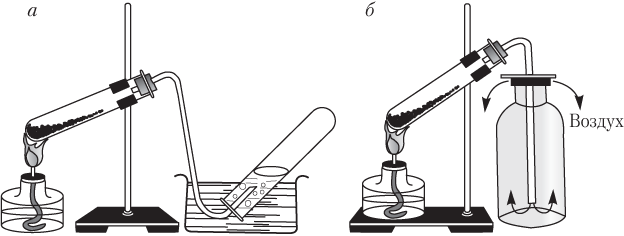
Очевидно, что способом вытеснения воды можно собирать только те газы, которые в воде не растворяются и с ней не взаимодействуют (водород, метан, азот, кислород). Таким способом нельзя собирать газы, которые в воде хорошо растворяются или с ней взаимодействуют (HCl, HBr, HI, HF, NH3). Оксид углерода(ІV) СО2 в воде растворяется сравнительно плохо, поэтому его можно собирать данным способом.
При собирании газа способом вытеснения воздуха нужно правильно располагать пробирки:
- горлышком вверх, если газ тяжелее воздуха, т.е. M (газа) > M (возд). Примеры: CO2, SO2, HCl;
- горлышком вниз, если газ легче воздуха, т.е. M (газа) < M (возд). Примеры: H2, Ne, NH3, CH4.
Для характеристики газов используют молярную концентрацию c, равную отношению химического количества газа к объему порции газа:
Смеси газов подобно индивидуальным газам характеризуются молярной (относительной молекулярной) массой, плотностью ρ, относительной плотностью D по другому газу, а также массовыми w и объемными φ долями отдельных газов:
, (1.22)
, (1.23)
, (1.24)
, (1.25)
, (1.26)
. (1.27)
Молярную массу смеси газов удобно находить по объемным долям и молярным массам отдельных газов:
M (смеси) = M 1φ1 + M 2φ2 + M 3φ3 + ... + M n φ n . (1.28)
Очевидно:
φ1 + φ2 + φ3 + ... + φ n = 1.
Для смеси двух газов (φ1 + φ2 = 1) φ2 = 1 − φ1. Тогда
. (1.29)
Пример 1.7. Найдите молярную массу газовой смеси (н.у.), состоящей из азота объемом (н.у.) 1,12 дм3 и кислорода массой 5,76 г.
Решение. По формулам (1.12) и (1.17) находим химическое количество газов и смеси:
(моль),
(моль).
Таким образом,
(моль).
По формуле (1.25) находим объемные доли газов в смеси:
,
или (так как смесь состоит из двух газов):
φ(O2) = 1 − 0,217 = 0,783.
По формуле (1.29) находим молярную массу смеси:
;
(г/моль).
Ответ: 31,2 г/моль.
1. Молярная масса смеси газов находится между значениями молярной массы самого легкого и самого тяжелого газа смеси. Например, молярная масса смеси NH3 (M = 17 г/моль) и CO2 (М = 44 г/моль) в зависимости от объемных долей газов может принимать значения 17 < M (смеси) < 44 (г/моль).
2. Если молярные массы газов в смеси одинаковые, то молярная масса смеси не зависит от объемных долей отдельных газов. Например, молярная масса смеси CO, C2H2 и N2 всегда равна 28 г/моль независимо от объемных долей компонентов.
3. Если к смеси газов добавляется газ, M которого больше, чем M самого тяжелого газа смеси, то M (смеси) возрастает. Например, если к различным по составу смесям N2 и O2 добавлять CO2, то M (смеси) возрастет.
4. Если к смеси газов добавляется газ, M которого меньше M самого легкого газа смеси, то M (смеси) смеси уменьшается. Например, если к различным по составу смесям Ne и Ar добавлять He, то M (смеси) уменьшится.
5. При равенстве объемных долей газов в смеси молярная масса смеси равна среднеарифметическому молярных масс отдельных газов. Например, для смеси равных объемов CO2 и O2:
г/моль.









