Химия
Соли — сложные вещества, состоящие из катиона металла, аммония или другой сложной частицы (например, ) и аниона кислотного остатка.
Классификация солей показана на рис. 7.1.

Средние соли — продукты полного замещения атомов водорода в кислоте на атом (атомы) металла: CuSO4, Ca3(PO4)2. К средним солям относятся также соли аммония (NH4Cl, NH4NO3) и замещенного аммония ([CH3NH3]2SO4). Средние соли в соответствующих реакциях образуют все кислоты, независимо от основности.
Кислые соли ( гидросоли) — продукты неполного замещения атомов водорода в кислоте на атом металла; кислые соли образуются также в реакциях аммиака и аминов с двух- и более основными кислотами: NH4HSO4, CH3NH3HSO4.
Кислые соли образуют только двух- и более основные кислоты (H2SO4, H2S, H3PO4 и т.п.)
В названиях кислых солей используется приставка гидро- с указанием, если нужно, числа атомов H в формульной единице соли, например: KHS – гидросульфид калия, NaH2PO4 — дигидрофосфат натрия.
Основные соли ( гидроксосоли) — продукты неполного замещения гидроксогрупп в основании на кислотные остатки.
Основные соли образуют только двух- и более кислотные гидроксиды (Mg(OH)2, Al(OH)3, Cu(OH)2 и т.п.).
В названиях основных солей используется приставка гидроксо- с указанием, если нужно, числа группы OH в формульной единице соли, например: (MgOH)NO3 — нитрат гидроксомагния, (CuOH)Cl — хлорид гидроксомеди(I), [Al(OH)2]2SO4 — сульфат дигидроксоалюминия.
Для солей характерно немолекулярное (ионное) строение, поэтому при обычных условиях соли — твердые вещества и их состав выражается формульными единицами. Соли могут иметь окраску (K2Cr2O7 — оранжевый, Ag3PO4 — желтый), все соли s-металлов бесцветные. Большинство солей ядовитые.
Подавляющее число солей — сильные электролиты (см. гл. 11). Растворимость солей в воде различна: хорошо растворимые (NaCl, KNO3), малорастворимые (CaSO4, MgSO3), нерастворимые (AgCl, BaSO4, CaCO3).
Ранее уже были рассмотрены реакции средних солей со щелочами (см. 6.2.2) и кислотами (см. 7.1.2).
1. Водные растворы солей взаимодействуют с металлами. Реакция возможна при одновременном соблюдении следующих условий:
а) исходная соль растворяется в воде;
б) в реакцию вступает металл более активный (т.е. расположенный в ряду активности металлов левее), чем металл, входящий в состав соли.
Эта реакция относится к типу окислительно-восстановительных реакций замещения, в результате образуются новые соль и металл:
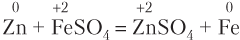
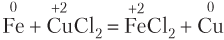
В водных растворах в реакции замещения с солями не вступают щелочные и щелочноземельные металлы, так как из-за высокой активности они реагируют с водой.
Например, при внесении натрия в водный раствор AlCl3 возможно протекание реакций:
2Na + 2H2O = 2NaOH + H2↑
3NaOH + AlCl3 = Al(OH)3↓ + 3NaCl
3NaOH + Al(OH)3 = Na3[Al(OH)6]
Соединения Fe(III) обладают выраженными окислительными свойствами, поэтому соли Fe(III) могут взаимодействовать даже с теми металлами, которые в электрохимическом ряду расположены правее железа (т.е. с менее активными металлами); металл при этом не образуется:
2FeCl3 + Cu = 2FeCl2 + CuCl2
2FeCl3 + Hg = 2FeCl2 + HgCl2
2. Соли реагируют между собой. Реакция возможна при одновременном соблюдении следующих условий:
а) обе соли растворяются в воде;
б) продуктом реакции является нерастворимая соль (осадок):
MgSO4 + BaCl2 = BaSO4↓ + MgCl2
CuCl2 + 2AgNO3 = Cu(NO3)2 + 2AgCl↓
C растворимой солью может реагировать и малорастворимая соль, если образуется нерастворимая соль:
Ag2SO4 (м) + 2KCl = 2AgCl (н) + K2SO4
PbCl2 (м) + K2S = PbS (н) + 2KCl
3. Ряд солей при нагревании разлагаются до плавления:
нитраты:
2Cu(NO3)2

карбонаты:
CaCO3

гидрокарбонаты:
2KHCO3

4. Некоторые соли необратимо разлагаются водой:
Al2S3 + 6H2O = 2Al(OH)3↓ + 3H2S↑
5. Водные растворы и расплавы солей подвергаются электролизу (см. 8.8).
6. Средние соли многоосновных кислот реагируют с кислотами с образованием кислых солей:
K2CO3 + H2CO3 = 2KHCO3
Na2SO3 + H2SO3 = 2NaHSO3
или смеси солей:
K2CO3 + HCl = KCl + KHCO3
K3PO4 + H2SO4 = K2SO4 + KH2PO4
Наиболее распространенные способы получения средних солей приведены в табл. 7.3.
| Тип реакции | Примеры |
|---|---|
| Металл + неметалл | Cu + Cl2 = CuCl2
Fe + S = FeS |
| Основный оксид + кислота | CaO + 2HNO3 = Ca(NO3)2 + H2O |
| Основный оксид + кислотный оксид | K2O + SO3 = K2SO4 |
| Кислотный оксид + щелочь | SO2 + 2NaOH = Na2SO3 + H2O |
| Кислота + основание | H2SO4 + Zn(OH)2 = ZnSO4 + 2H2O |
| Кислота + соль | 2HCl + Na2CO3 = 2NaCl + H2O + CO2↑ |
| Щелочь + соль | 2KOH + CuSO4 = K2SO4 + Cu(OH)2↓ |
| Растворимая соль (1) + растворимая соль (2) | Na2SO4 + BaCl2 = BaSO4↓ + 2NaCl |
| Растворимая соль + металл | Zn + CuSO4 = ZnSO4 + Cu↓ |
| Кислота + металл | Fe + 2HCl = FeCl2 + H2↑ |
| Кислая соль + щелочь | NaHCO3 + NaOH = Na2CO3 + H2O |
| Кислая соль + кислота | 2KHSO3 + H2SO4 = K2SO4 + 2SO2↑ + 2H2O |
| Нагревание солей | 2KNO3
 2KNO2 + O2↑ 2KNO2 + O2↑ |
| Основная соль + кислота | (CuOH)Cl + HCl = CuCl2 + H2O |
| Основная соль + щелочь | (MgOH)NO3 + NaOH = = Mg(OH)2↓ + NaNO3 |
Растворимость кислых солей в воде, как правило, выше, чем средних.
Все кислые соли по типу реакции соединения реагируют с аммиаком и его водными растворами:
NH3 + NH4H2PO4 = (NH4)2HPO4
NH3 + KHCO3 = NH4KCO3
NH3 ⋅ H2O + NH4HCO3 = (NH4)2CO3 + H2O
Все кислые соли реагируют со щелочами, образуя:
а) средние соли:
NaHSO3 + NaOH = Na2SO3 + H2O
2KHCO3 + 2NaOH = K2CO3 + Na2CO3 + 2H2O
Ba(H2PO4)2 + 2Ba(OH)2 = Ba3(PO4)2↓ + 4H2O
б) менее «кислую» соль, т.е. содержащую в формульной единице меньше атомов водорода (такая реакция характерна для дигидрофосфатов):
KH2PO4 + KOH = K2HPO4 + H2O
в) смесь различных солей и щелочи; например, при мольном отношении n(KHSO3)/n(Ba(OH)2) = 2 : 1 реакция протекает по уравнению
2KHSO3 + Ba(OH)2 = K2SO3 + BaSO3↓ + 2H2O
а при мольном отношении 1 : 1 взаимодействие описывается уравнением
KHSO3 + Ba(OH)2 = BaSO3↓ + KOH + H2O
Кислые соли, образованные слабыми кислотами, реагируют с сильными кислотами, при этом вытесняется более слабая кислота:
KHCO3 + HCl = KCl + H2O + CO2↑
2NaH2PO4 + H2SO4 = Na2SO4 + 2H3PO4
Кислые соли могут вступать в реакцию обмена с другими солями:
Сa(HCO3)2 + K2CO3 = CaCO3↓ + 2KHCO3
Однако реакция между, например, CaCl2 и KHCO3 не протекает, так как в этом случае не образуется осадок (гидрокарбонат кальция в воде растворим).
Пример 7.4. Кислая соль в качестве конечного продукта может образоваться при взаимодействии:
а) Ba(OH)2 (p-p) и CO2 (изб);
б) KOH (p-p) и N2O5;
в) P2O5 и Ca(OH)2 (р-р, изб);
г) K2SO3 и SO2 (р-р).
Решение. Кислая соль образуется в реакциях:
а) Ba(OH)2 (p-p) + 2CO2 (изб) = Ba(HCO3)2
г) K2SO3 + SO2 + H2O = 2KHSO3
Оксиду N2O5 отвечает одноосновная кислота HNO3, поэтому в реакции между KOH и N2O5 образуется только средняя соль:
2KOH + N2O5 = 2KNO3 + H2O
В избытке щелочи при взаимодействии P2O5 и Ca(OH)2 образуется средняя соль:
3Ca(OH)2 + P2O5 = Ca3(PO)4↓ + 3H2O
Ответ: а), г).
В реакциях щелочей и кислот или кислотных оксидов при избытке щелочи образуется средняя соль, а при избытке кислоты или кислотного оксида — кислая соль
Пример 7.5. Гидрокарбонат калия в водном растворе реагирует:
а) c CO2; б) SiO2; в) NaOH; г) HCl.
Решение. Из указанных соединений с гидрокарбонатом калия взаимодействуют NaOH:
2KHCO3 + 2NaOH = K2CO3 + Na2CO3 + 2H2O
и HCl:
KHCO3 + HCl = KCl + H2O + CO2↑
Ответ: б), г).
Пример 7.6. Дана цепочка одностадийных превращений:
Ba3(PO4)2 Ba(H2PO4)2 BaHPO4 Ba(H2PO4)2 Ba3(PO4)2
Укажите, на каких этапах требуется добавление: а) фосфорной кислоты; б) щелочи.
Решение. Добавление H2PO4 требуется на этапах 1 и 3:
Ba3(PO4)2 + 4H3PO4 = 3Ba(H2PO4)2
BaHPO4 + H3PO4 = Ba(H2PO4)2
На этапах 2 и 4 требуется добавление щелочи:
Ba(H2PO4)2 + Ba(OH)2 = 2BaHPO4↓ + 2H2O
Ba(H2PO4)2 + 2Ba(OH)2 = Ba3(PO4)2↓ + 4H2O
Ответ: а) 1, 3; б) 2, 4.
Способы получения: кислых солей приведены в табл. 7.4.
| Тип реакции | Примеры |
|---|---|
| Металл + двух- и более основная кислота | Ca + 2H3PO4 = Ca(H2PO4)2 + H2↑ |
| Основание + двух- и более основная кислота | NaOH + H3PO4 = NaH2PO4 + H2O 2NaOH + H3PO4 = Na2HPO4 + 2H2O Ba(OH)2 + H3PO4 = BaHPO4↓ + 2H2O |
| Щелочь + кислотный оксид, которому отвечает двух- и более основная кислота (не образуют кислых солей N2O5, Mn2O7, N2O3, оксиды хлора) | 2NaOH + P2O5 + H2O = 2NaH2PO4
4NaOH + P2O5 = 2Na2HPO4 + H2O Ba(OH)2 + 2CO2 = Ba(HCO3)2 KOH + SO2 = KHSO3 |
| Основный оксид + двух- и более основная кислота | K2O + 2H3PO4 = 2KH2PO4 + H2O K2O + H3PO4 = K2HPO4 + H2O |
| Средняя соль + кислота | Na2SO4 + H2SO4 = 2NaHSO4
K2SO3 + H2O + SO2 = 2KHSO3 Ca3(PO4)2 + 4H3PO4 = 3Ca(H2PO4)2 |
| Гидрофосфаты реагируют с Н3РО4 и превращаются в дигидрофосфаты | K2HPO4 + H3PO4 = 2KH2PO4
CaHPO4 + H3PO4 = Ca(H2PO4)2 |
| Дигидрофосфаты в реакциях со щелочами могут превращаться в гидрофосфаты (при избытке щелочи образуются средние соли) | Ba(H2PO4)2 + Ba(OH)2 = = 2BaHPO4↓ + 2H2O |
| Аммиак (гидрат аммиака) + двух- и более основная кислота | NH3 + H2SO4 = NH4HSO4
NH3 · H2O + H3PO4 = = NH4H2PO4 + H2O |
| Соль слабой кислоты + сильная кислота (недостаток) | K2CO3 + HCl = KHCO3 + KCl |
| Гидрат аммиака + кислотный оксид | NH3 · H2O + CO2 = NH4HCO3 + H2O |
Рассмотрим некоторые химические свойства основных солей.
Основные соли реагируют со щелочами:
Mg(OH)Cl + KOH = KCl + Mg(OH)2↓
и кислотами:
Mg(OH)Cl + HCl = MgCl2 + H2O
Способы получения основных солей приведены в табл. 7.5.
| Тип реакции | Примеры |
|---|---|
| Кислота + двух- и более кислотное основание (избыток) | Cu(OH)2 + HCl = (CuOH)Cl + H2O Al(OH)3 + HNO3 = [Al(OH)2]NO3 + H2O Al(OH)3 + 2HNO3 = (AlOH)(NO3)2 + H2O Al(OH)3 + H2SO4 = (AlOH)SO4 + 2H2O 2Al(OH)3 + H2SO4 = [Al(OH)2]2SO4 + 2H2O |
| Растворимая соль + щелочь | AlCl3 + 2KOH = Al(OH)2Cl + 2KCl Cr2(SO4)3 + 4NaOH = [Cr(OH)2]2SO4 + 2Na2SO4 |
В реакциях кислот с солями анионного типа, образованными алюминием, цинком и бериллием, т.е. металлами, оксиды и гидроксиды которых проявляют амфотерные свойства, состав продуктов сильно зависит от мольного соотношения реагентов:
- при взаимодействии с HCl
K3[Al(OH)6] + 3HCl = 3KCl + Al(OH)3↓ + 3H2O
K3[Al(OH)6] + 6HCl = 3KCl + AlCl3↓ + 6H2O
KAlO2 + HCl + H2O = KCl + Al(OH)3↓
KAlO2 + 4HCl = KCl +AlCl3 + 2H2O
- при взаимодействии с H2SO4
K2[Zn(OH)4] + H2SO4 = K2SO4 + Zn(OH)2↓ + H2O
K2[Zn(OH)2] + H2SO4 = K2SO4 + ZnSO4 + 4H2O
K2ZnO2 + H2SO4 = K2SO4 + Zn(OH)2↓
K2ZnO2 + 2H2SO4 = K2SO4 + ZnSO4 + 2H2O
Аналогично соединениям цинка с кислотами реагируют соединения бериллия.
При избытке кислоты образуются две средние соли, а при недостатке кислоты — средняя соль и амфотерный гидроксид
Рассмотрим случаи влияния порядка сливания реагентов на природу образующихся солей (рис. 7.2).

Предположим, что к раствору ортофосфорной кислоты по каплям добавляют раствор гидроксида бария. В этом случае реакция вначале протекает в избытке кислоты, поэтому порядок образования солей таков: вначале Ba(H2PO4)2, затем BaHPO4 и, наконец, средняя соль (в избытке щелочи) Ba3(PO4)2.
2H3PO4 + Ba(OH)2 = Ba(H2PO4)2 + 2H2O
Ba(H2PO4)2 + Ba(OH)2 = 2BaHPO4↓ + 2H2O
2BaHPO4 + Ba(OH)2 = Ba3(PO4)2↓ + 2H2O
Изменим порядок сливания растворов реагентов, т.е. к раствору щелочи будем приливать раствор кислоты. Вначале реакция протекает в избытке щелочи и образуется средняя соль Ba3(PO4)2, которая по мере добавления кислоты будет превращаться сначала в BaHPO4, а затем в Ba(H2PO4)2, т.е. вначале осадок образуется, затем растворяется.
3Ba(OH)2 + 2H3PO4 = Ba3(PO4)2↓ + 6H2O
Ba3(PO4)2 + H3PO4 = 3BaHPO4↓
BaHPO4 + H3PO4 = Ba(H2PO4)2
Порядок сливания реагентов влияет на состав продуктов и в случае AlCl3 и KOH.
К раствору AlCl3 по каплям добавляют раствор KOH:
AlCl3 + KOH = AlOHCl2 + KCl
AlOHCl2 + KOH = Al(OH)2Cl + KCl
Al(OH)2Cl + 3KOH = Al(OH)3↓ + KCl
Al(OH)3 + 3KOH = K3[Al(OH)6]
К раствору KOH по каплям добавляют раствор AlCl3. В этом случае вначале образуется комплексная соль:
6KOH + AlCl3 = K3[Al(OH)6] + 3KCl,
а конечными продуктами будут Al(OH)3 и KCl.










