Химия
Кислоты — это электролиты, при диссоциации которых в качестве положительно заряженных ионов образуются только катионы водорода H+ (точнее — ионы гидроксония H3O+).
Другое определение: кислоты — это сложные вещества, состоящие из атома водорода и кислотных остатков (табл. 7.1).
| Формула кислоты | Название кислоты | Кислотный остаток (анион) | Название солей (средних) |
|---|---|---|---|
| HF | Фтористоводородная (плавиковая) | F− | Фториды |
| HCl | Хлористоводородная (соляная) | Cl− | Хлориды |
| HBr | Бромистоводородная | Br− | Бромиды |
| HI | Иодистоводородная | I− | Иодиды |
| H2S | Сероводородная | S2− | Сульфиды |
| H2SO3 | Сернистая | Сульфиты | |
| H2SO4 | Серная | Сульфаты | |
| HNO2 | Азотистая | Нитриты | |
| HNO3 | Азотная | Нитраты | |
| H2SiO3 | Кремниевая | Силикаты | |
| HPO3 | Метафосфорная | Метафосфаты | |
| H3PO4 | Ортофосфорная | Ортофосфаты (фосфаты) | |
| H4P2O7 | Пирофосфорная (двуфосфорная) | Пирофосфаты (дифосфаты) | |
| HMnO4 | Марганцевая | Перманганаты | |
| H2CrO4 | Хромовая | Хроматы | |
| H2Cr2O7 | Дихромовая | Дихроматы (бихроматы) | |
| H2SeO4 | Селеновая | Селенаты | |
| H3BO3 | Борная | Ортобораты | |
| HClO | Хлорноватистая | ClO– | Гипохлориты |
| HClO2 | Хлористая | Хлориты | |
| HClO3 | Хлорноватая | Хлораты | |
| HClO4 | Хлорная | Перхлораты | |
| H2CO3 | Угольная | Карбонаты | |
| CH3COOH | Уксусная | CH3COO− | Ацетаты |
| HCOOH | Муравьиная | HCOO− | Формиаты |
При обычных условиях кислоты могут быть твердыми веществами (H3PO4, H3BO3, H2SiO3) и жидкостями (HNO3, H2SO4, CH3COOH). Эти кислоты могут существовать как в индивидуальном (100%-ном виде), так и в виде разбавленных и концентрированных растворов. Например, как в индивидуальном виде, так и в растворах известны H2SO4, HNO3, H3PO4, CH3COOH.
Ряд кислот известны только в растворах. Это все галогеноводородные (HCl, HBr, HI), сероводородная H2S, циановодородная (синильная HCN), угольная H2CO3, сернистая H2SO3 кислота, которые представляют собой растворы газов в воде. Например, соляная кислота — это смесь HCl и H2O, угольная — смесь CO2 и H2O. Понятно, что употреблять выражение «раствор соляной кислоты» неправильно.
Большинство кислот растворимы в воде, нерастворима кремниевая кислота H2SiO3. Подавляющее число кислот имеют молекулярное строение. Примеры структурных формул кислот:

В большинстве молекул кислородсодержащих кислот все атомы водорода связаны с кислородом. Но есть и исключения:
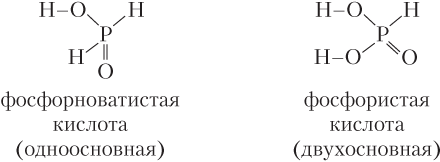
Кислоты классифицируют по ряду признаков (табл. 7.2).
| Признак классификации | Тип кислоты | Примеры |
|---|---|---|
| Число ионов водорода, образующихся при полной диссоциации молекулы кислоты | Одноосновные | HCl, HNO3, CH3COOH |
| Двухосновные | H2SO4, H2S, H2CO3 | |
| Трехосновные | H3PO4, H3AsO4 | |
| Наличие или отсутствие в молекуле атома кислорода | Кислородсодержащие (кислотные гидроксиды, оксокислоты) | HNO2, H2SiO3, H2SO4 |
| Бескислородные | HF, H2S, HCN | |
| Степень диссоциации (сила) | Сильные (полностью диссоциируют, сильные электролиты) | HCl, HBr, HI, H2SO4 (разб), HNO3, HClO3, HClO4, HMnO4, H2Cr2O7 |
| Слабые (диссоциируют частично, слабые электролиты) | HF, HNO2, H2SO3, HCOOH, CH3COOH, H2SiO3, H2S, HCN, H3PO4, H3PO3, HClO, HClO2, H2CO3, H3BO3, H2SO4 (конц) | |
| Окислительные свойства | Окислители за счет ионов Н+ (условно кислоты-неокислители) | HCl, HBr, HI, HF, H2SO4 (разб), H3PO4, CH3COOH |
| Окислители за счет аниона (кислоты-окислители) | HNO3, HMnO4, H2SO4 (конц), H2Cr2O7 | |
| Восстановители за счет аниона | HCl, HBr, HI, H2S (но не HF) | |
| Термическая устойчивость | Существуют только в растворах | H2CO3, H2SO3, HClO, HClO2 |
| Легко разлагаются при нагревании | H2SO3, HNO3, H2SiO3 | |
| Термически устойчивы | H2SO4 (конц), H3PO4 |
Все общие химические свойства кислот обусловлены наличием в их водных растворах избытка катионов водорода H+ (H3O+).
1. Вследствие избытка ионов H+ водные растворы кислот изменяют окраску лакмуса фиолетового и метилоранжа на красную, (фенолфталеин окраску не изменяет, остается бесцветным). В водном растворе слабой угольной кислоты лакмус не красный, а розовый, раствор над осадком очень слабой кремниевой кислоты вообще не изменяет окраску индикаторов.
2. Кислоты взаимодействуют с основными оксидами, основаниями и амфотерными гидроксидами, гидратом аммиака (см. гл. 6).
Пример 7.1. Для осуществления превращения BaO → BaSO4 можно использовать: а) SO2; б) H2SO4; в) Na2SO4; г) SO3.
1) а, б;
2) б, в;
3) б, г;
4) б, в, г.
Решение. Превращение можно осуществить, используя H2SO4:
BaO + H2SO4 = BaSO4↓ + H2O
и SO3:
BaO + SO3 = BaSO4
Na2SO4 с BaO не реагирует, а в реакции BaO с SO2 образуется сульфит бария:
BaO + SO2 = BaSO3
Ответ: 3).
3. Кислоты реагируют с аммиаком и его водными растворами с образованием солей аммония:
HCl + NH3 = NH4Cl — хлорид аммония;
H2SO4 + 2NH3 = (NH4)2SO4 — сульфат аммония.
4. Кислоты-неокислители с образованием соли и выделением водорода реагируют с металлами, расположенными в ряду активности до водорода:
H2SO4 (разб) + Fe = FeSO4 + H2↑
2HCl + Zn = ZnCl2 = H2↑
Взаимодействие кислот-окислителей (HNO3, H2SO4 (конц)) с металлами очень специфично и рассматривается при изучении химии элементов и их соединений.
5. Кислоты взаимодействуют с солями. Реакция имеет ряд особенностей:
а) в большинстве случаев при взаимодействии более сильной кислоты с солью более слабой кислоты образуется соль слабой кислоты и слабая кислота или, как говорят, более сильная кислота вытесняет более слабую. Ряд убывания силы кислот выглядит так:
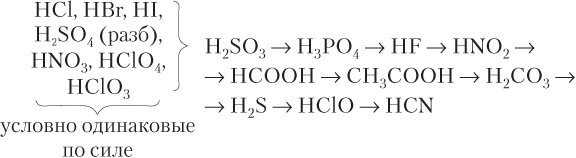
Примеры протекающих реакций:
2HCl + Na2CO3 = 2NaCl + H2O + CO2↑
H2CO3 + Na2SiO3 = Na2CO3 + H2SiO3↓
2CH3COOH + K2CO3 = 2CH3COOK + H2O + CO2↑
3H2SO4 + 2K3PO4 = 3K2SO4 + 2H3PO4
Не взаимодействуют между собой, например, KCl и H2SO4 (разб), NaNO3 и H2SO4 (разб), K2SO4 и HCl (HNO3, HBr, HI), K3PO4 и H2CO3, CH3COOK и H2CO3;
б) в некоторых случаях более слабая кислота вытесняет из соли более сильную:
CuSO4 + H2S = CuS↓ + H2SO4
3AgNO3 (разб) + H3PO4 = Ag3PO4↓ + 3HNO3.
Такие реакции возможны тогда, когда осадки полученных солей не растворяются в образующихся разбавленных сильных кислотах (H2SO4 и HNO3);
в) в случае образования осадков, нерастворимых в сильных кислотах, возможно протекание реакции между сильной кислотой и солью, образованной другой сильной кислотой:
BaCl2 + H2SO4 = BaSO4↓ + 2HCl
Ba(NO3)2 + H2SO4 = BaSO4↓ + 2HNO3
AgNO3 + HCl = AgCl↓ + HNO3
Пример 7.2. Укажите ряд, в котором приведены формулы веществ, которые реагируют с H2SO4 (разб).
1) Zn, Al2O3, KCl (p-p); 3) NaNO3 (p-p), Na2S, NaF;2) Cu(OH)2, K2CO3, Ag; 4) Na2SO3, Mg, Zn(OH)2.Решение. С H2SO4 (разб) взаимодействуют все вещества ряда 4):
Na2SO3 + H2SO4 = Na2SO4 + H2O + SO2↑
Mg + H2SO4 = MgSO4 + H2↑
Zn(OH)2 + H2SO4 = ZnSO4 + 2H2O
В ряду 1) неосуществима реакция с KCl (p-p), в ряду 2) — с Ag, в ряду 3) — с NaNO3 (p-p).
Ответ: 4).
6. Очень специфически в реакциях с солями ведет себя концентрированная серная кислота. Это нелетучая и термически устойчивая кислота, поэтому из твердых (!) солей вытесняет все сильные кислоты, так как они более летучие, чем H2SO4 (конц):
KCl (тв) + H2SO4 (конц) 
2KCl (тв) + H2SO4 (конц) 
NaNO3 (тв) + H2SO4 (конц) 
Соли, образованные сильными кислотами (HBr, HI, HCl, HNO3, HClO4), реагируют только с концентрированной серной кислотой и только находясь в твердом состоянии
Пример 7.3. Концентрированная серная кислота, в отличие от разбавленной, реагирует:
1) с KF;
2) Na2CO3;
3) KNO3 (тв);
4) Na3PO4.
Решение. С KF, Na2CO3 и Na3PO4 реагируют обе кислоты, а с KNO3 (тв) — только H2SO4 (конц).
Ответ: 3).
Способы получения кислот весьма разнообразны.
Бескислородные кислоты получают:
- растворением в воде соответствующих газов:
HCl (г) + H2O (ж) → HCl (p-p)
H2S (г) + H2O (ж) → H2S (р-р)
- из солей вытеснением более сильными или менее летучими кислотами:
FeS + 2HCl = FeCl2 + H2S
KCl (тв) + H2SO4 (конц) = KHSO4 + HCl↑
Na2SO3 + H2SO4
Кислородсодержащие кислоты получают:
- растворением соответствующих кислотных оксидов в воде, при этом степень окисления кислотообразующего элемента в оксиде и кислоте остается одинаковой (исключение — NO2):
N2O5 + H2O = 2HNO3
SO3 + H2O = H2SO4
P2O5 + 3H2O 

- окислением неметаллов кислотами-окислителями:
S + 6HNO3 (конц) = H2SO4 + 6NO2↑ + 2H2O
- вытеснением сильной кислоты из соли другой сильной кислоты (если выпадает нерастворимый в образующихся кислотах осадок):
Ba(NO3)2 + H2SO4 (разб) = BaSO4↓ + 2HNO3
AgNO3 + HCl = AgCl↓ + HNO3
- вытеснением летучей кислоты из ее солей менее летучей кислотой.
С этой целью чаще всего используют нелетучую термически устойчивую концентрированную серную кислоту:
NaNO3 (тв) + H2SO4 (конц) 
KClO4 (тв) + H2SO4 (конц) 
- вытеснением более слабой кислоты из ее солей более сильной кислотой:
Ca3(PO4)2 + 3H2SO4 = 3CaSO4↓ + 2H3PO4
NaNO2 + HCl = NaCl + HNO2
K2SiO3 + 2HBr = 2KBr + H2SiO3↓










